努力理解内在混乱区域互动产生各种答案

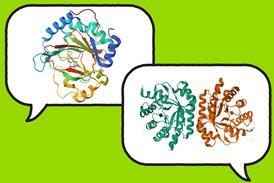
有点讽刺的是,正像剖分蛋白质分子结晶结构方法 已经超载, 我们开始发现这些方法可能不总能帮助开发以蛋白质为对象的药首先是同步子辐射 现在自由电子激光exbrightx射线束源可减少数据收集时间和晶体学晶体大小一号同时 AlphaFold单从序列数据中可以预测多蛋白结构,精度可观
问题不总是结构问题取a最近研究由英国伦敦大学学院团队展示动态关键作用和酶探索异性景观能力2研究者指出,单片蛋白变异可显著改变活动,同时微弱地影响晶体结构,因为主动一致性在动态状态分布中只是微弱表示
固有混乱区域
结构判断函数能力(并因此表示哪些药物分子可能干扰函数)的更基本限制产生时没有结构可言多蛋白质,包括细胞行为最核心部分-例如规范基因调控的转录因子-都有大量结构混乱症表示内含固有混乱区域,它有时构成几乎全蛋白3分子往往易软化求解,缺二类特征结构如alpha异端或贝表,难结晶
它们的原型性通常使蛋白质像这个相当非选择性这可能解释为什么坐在细胞交互网络某些中心点的蛋白质-如肿瘤抑制器p53-此类弹性允许蛋白质在网络中搭建新链路,有可能促进父机的演化
自然无序区域令蛋白质偏切并聚, 也不奇怪这种蛋白质在凝聚物和凝聚中的特征稠密蛋白质块分相位细胞内部似乎对从基因调节到RNA切片等一系列函数至关重要4与神经退化性疾病相关联的细胞毒性集合,如阿尔茨海默氏正因如此 内在无序蛋白质 可能成为药物的重要目标
一组研究人员主要设在英国剑桥市,现已开发出计算法确定哪类蛋白最能干预凝聚层5测试三种类蛋白质 研究这些干预如何影响模型细胞系统汇总行为
类似方法辅助机器学习 可能通过压缩数据识别候选药目标研究者可能想理解分子交互背后的原则 引入合理设计元素
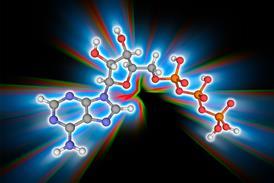
难解问题,因为内在干扰蛋白缺乏定序蛋白所见的锁键约束选择-尽管有些人接受多点排序结构时绑定6形状不是决定因素 是什么一种建议是凝聚层使用中的蛋白质sticky补丁沿链组成多弱关联7最近几篇论文更仔细地研究固有混乱区域之间的特殊交互作用,以了解热力学总原理
中余
和生物分子交互作用一样,寄生物贡献-对齐互相吸引的分组-和寄生物间平衡分解-分解分解-分解分解-分解分解-分解分解分解-分解自解水或分解链运动下降面值新研究 似乎得出不同结论 关重题Debasis Saha和Biman Jana印度加尔各答科学培养协会调查指导因素模拟浸化物二分化假设这种粗略近似凝聚状状并判定正电荷粒子最能制造稠密相位8
同时,瑞士苏黎世大学Benjamin Schuler和同事查看一对正负电荷干扰蛋白大通量投送绑定自发布反射九九Saumyak Mukherjee和Lars Schäfer在德国Ruhr大学Bochum得出结论悬浮水释放的微量效果稠密凝聚物至少与蛋白-蛋白10
从中得出什么结论万一无序蛋白调用 各种互换性来做作业 并不奇怪 魔鬼在细节中大问题在于能否利用细节控制这些集体模糊交互作用 — — 并治病
引用
开工普迪亚姆施密特普范德斯特鲁克特丁,2020,702410210.1063/1.5144516)
二叉VKShukla L西门和DF汉森PNAS2023120e231091012010.1073/pnas.2310910120)
3级HJDyson和PEWright纳特公元前模尔细胞生物2005年6公元19710.1038/nrm1589)
4级Y申和CPBrangwinne科学类2017年357eaf438210.1126/science.aaf4382)
5级CMLINet al.,PNAS2023120e2300212010.1073/pnas.2300215120)
6级VNUVERKYAdv.蛋白化石斯特鲁克特比奥尔.20181108510.1016/bs.apcsb.2017.06.005)
7kmruffet al.,模尔单元格内202282319810.1016/j.molcel.2022.06.024)
八点八分D Saha和BjanaJ.物理类切姆B级2023127号665610.1021/acs.jpcb.3c03087)
9.Achowdhury大全et al.,PNAS2023120e230403612010.1073/pnas.2304036120)
10号SMukherjee和LSHAFER纳特通信网202314589210.1038/s41467-023-41586-y)
















尚没有备注