理解蛋白折叠和稳定可带来新蛋白质,希望创建结构可实现新化学

英国和美国科学家设计并合成非自然蛋白结构,使用理论计算探索影响蛋白折合和稳定的因素期望最终能用新生物或化学应用生成蛋白质
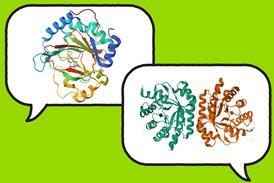
形状中蛋白折数对功能至关重要, 多重疾病如阿尔茨海默症被认为是误叠蛋白分解的结果然而,尽管控制蛋白折叠的化学力量为人所理解,但他们竞争和交互的复杂性意味着预测某蛋白如何从氨基酸序列折叠是极其困难的。由两个独立的研究组推导出规则 规范特定类蛋白质的稳定性 用这些规则预测和合成自然中未发现的稳定结构
由环状氨基酸链组成, 并自圈入“超级焦土”。结构特征相对较少参数,例如圈形曲折及其维度蛋白质结构以这种形状相对理解度较高,并设计出数种新蛋白质,尽管这些结构主要模拟自然结构两组-第一组由大卫贝克美国西雅图华盛顿大学第二名德里克伍尔夫松英国布里斯托尔大学启动解锁特殊结构稳定或不稳定
寻找稳定
贝克集团寻找重复串行圈结构,经过固定数次曲折后,两组圈返回原创地构造圈圈从自然曲率拉开或压缩实现存储像泉水这样的潜在能量,并因此不那么稳定,因此Baker群寻找尽可能不受约束的结构即使是结构稳定, 是否接受蛋白质取决于氨基酸序列, 各种因素如疏水性交互作用研究者使用计算机算法搜索氨基酸序列,以采用这些非约束结构发现合适的序列后实验合成有趣的是,他们发现多合成蛋白比自然蛋白稳定热化一号
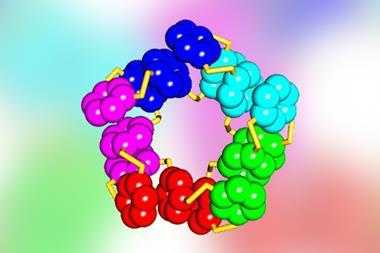
伍尔夫森集团集中研究卷圈结构变换物,称为危险桶,5个或5个以上螺旋柱环绕中央通道打包氨基酸组合稳定helix-helix互动并把这些嵌入全新危险桶计算模型中,以创建所需的多螺旋-赫利克斯交互作用,从而设计出理论上稳定的结构版本化学合成了22种蛋白质2
两组发现许多非自然结构, 并有兴趣了解他们是否能够做超出自然蛋白能力的事情Woolfsson集团希望使用结构漏洞生成离子通道或工程孔插槽Proteins执行体内所有重要过程,蛋白设计的目标是找出解决今日问题的新蛋白质和自然生成蛋白解进化问题
威廉德格拉多美国加利福尼亚大学旧金山分校表示,两组系统制定许多稳定规则的方式引出一些有趣的发现。举个例子, 贝克发现自然蛋白很少是最稳定的结构 显示它们向着 中位稳定进化









尚没有备注