弱相互作用稳定β-片,可能有助于了解疾病,如阿尔茨海默病
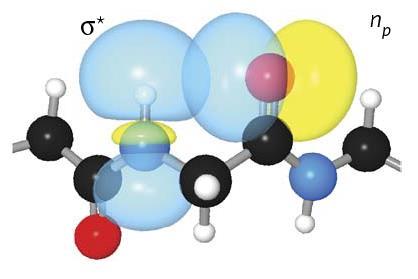
几十年来缺失的氢键似乎在稳定蛋白质的二级结构中起着重要作用,尤其是β-表。尽管这种结合很脆弱,但它足够常见,可以对典型蛋白质的稳定性产生累积影响,特别是那些与阿尔茨海默病等神经退行性疾病相关的蛋白质。理解这些相互作用是开发可靠的计算方法的关键,这些方法可以根据蛋白质序列建模3D蛋白质结构。
“几十年来,人们一直在研究蛋白质骨架的结构,但我们仍然没有意识到其中发生的所有化学相互作用,”他说罗伯特·纽贝里他是美国威斯康星大学麦迪逊分校的研究员,也是这篇论文的合著者。“我们已经在α-螺旋的主干中发现了第二种相互作用,似乎补充了几十年来已知的典型氢键,但在β-薄片中不知道类似的相互作用。”这启发了我们的工作,尤其是因为这些二级结构与蛋白质错误折叠疾病(如阿尔茨海默病)有关。”
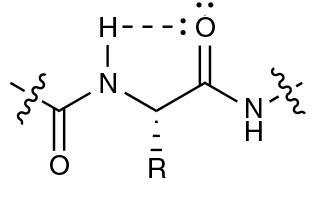
这个氢键是在酰胺质子和相同氨基酸的羰基氧之间形成的。这个美国研究小组使用了大量的计算和实验技术,研究了这种被称为C5的氢键。研究这种化学键的一种方法是制造经过工程改造的肽,使其形成较弱的氢键。研究人员发现,这些新肽更不稳定,其变性温度比自然结构低25°C。根据纽贝里的说法,这种相互作用可能被忽视了,因为“它不符合经典氢键的一些标准:它不是线性的,因此大多数计算机程序无法识别它”。然而,通过计算计算,“你实际上可以观察分子轨道,发现这个C5键是真的可能的,”纽贝里补充道。
盖尔·巴特利特他是该研究所的生物信息学研究员布里斯托大学他认为,“蛋白质是非常复杂的系统,对所有这些非共价相互作用之间的相互作用的理解还远远没有完成。尽管如此,我相信这项新工作是相当重要的,并将导致预测模型的力场和评分功能的改进。巴特利特指出:“这是第一次在蛋白质环境下,在溶液中研究C5的相互作用。”
新的计算方法将使研究人员能够更好地预测可以测序但不能分离或结晶的蛋白质的结构。纽贝里总结道:“在计算计算中包括C5氢键这样的相互作用,将提高研究人员设计新模型的能力,并最终开发出对抗神经退行性疾病的新药。”
参考文献
R W纽贝里和R T Raines,Nat,化学。医学杂志,2016年,DOI:10.1038 / nchembio.2206







暂无评论