我们的触觉和平衡是根深蒂固在我们的经验,但化学过程使它工作是什么?瑞秋巴西调查
试着闭上眼睛,用你的手指触摸你的鼻子。我们大多数人很容易这样做:我们有天生的能力感觉自己的肌肉拉伸,这给了我们一个平衡感和允许我们控制我们的运动。但给我们的我们的身体在做什么,被称为本体感受?直到最近还不清楚,但在2010年负责这是发现的蛋白质家族。事实证明这些蛋白质也让我们感觉触摸和很多更多。
神经科学家发现的家族Ardem Patapoutian在加州斯克里普斯研究所,我们,他将这两个相关的离子通道蛋白Piezo1 Piezo2——从希腊语中压力。在过去的七年已经变得明显,这些压电蛋白质是生物控制系统的基本组成部分。
我们只看到冰山一角对于他们的生理功能,”Jorg Grandl说,美国北卡罗来纳州杜克大学的神经生物学家。很难找到任何细胞在体内没有几个压电离子通道。虽然他们的重要性是显而易见的,这些令人印象深刻的mechanosensor蛋白质的具体结构和功能是一个开放的问题。
离子通道是pore-containing蛋白质,发现在细胞的脂质膜。他们打开和关闭控制离子流入细胞,引起细胞信号。许多电压门控——激活通道附近的电膜电位的变化——但压电离子通道开放的机械刺激,使钠、钾和钙离子进入细胞。两种人类形式的发现,Patapoutian证实Piezo2频道在2014年负责我们的触觉。1他的团队Piezo2蛋白的老鼠的感觉神经元和皮肤细胞,发现他们无法在几个触摸感觉刺激测试。
Patapoutian证实Piezo2之间的联系和本体感受也使用转基因小鼠,但这一次沉默Piezo2神经元意义上的肌肉。2老鼠无法正常行走。突变的蛋白质也与罕见的遗传疾病,没有本体感受的人离开。
压电离子通道蛋白质不是第一个发现应对机械力。属于一个家庭”,区别叫跋涉——potassium-selective机械敏感通道,”解释了菲利普·戈特利布从在美国纽约州立大学。他一直在研究离子通道为近20年的父亲弗雷德里克·萨克斯,他在1980年代中期发现离子通道可以将机械应力转换为电或生化信号。长途跋涉,这些mechanosensitive离子通道之一,存在于大脑和心脏神经细胞和似乎在预防癫痫的一个重要的角色。
机械触发离子通道在细菌中也被广泛的研究,因为他们发现在1980年代末。英吉利海峡MscL(大电导mechanosensitive通道)充当紧急阀,阻止细菌肿胀和破裂突然暴露于水。打开时,它允许通过分子的分子量高达1000 da控制细菌的渗透梯度。
大多数蛋白质机械力在某种程度上,“Patapoutian解释道,但蛋白质之间的区别是由机械力的调制和激活。虽然压力可以影响其他离子通道,Piezo1和2主要是为了应对机械、化学刺激。大多数细胞通过化学物质进行通信,但是感觉神经元需要响应其他信号,如温度或压力,并能够将这些物理刺激转化为电脉冲,以毫秒为单位。之前发现压电蛋白质Patapoutian的实验室已经发现了第一cold-activated离子通道(也作为一个薄荷醇受体,解释了冷感觉复合创建)。
但在某些时候我们意识到房间里的大象是mechanosensation Patapoutian说。几乎没有理解我们的触觉。我们知道有机械激活离子通道,我们知道他们会,但是他们的分子身份不清楚。”
压电蛋白质看起来不像任何我们所知,这使得他们很难学习
Jorg Grandl
Patapoutian着手改变这种通过识别鼠标或鼠细胞系显示机械激活电流的证据。他使用的膜片钳电生理技术,它使用一个玻璃微量吸液管电极吸收细胞膜的一小部分。读取的电压与参考电极周围的细胞浴。当机械应用于细胞表面的压力,任何变化可以探测到离子通道状态。
使用科学数据,最可能的蛋白质被确定和筛选使用小型干扰RNA (siRNA)击倒。介绍了小20 - 25碱基对RNA分子,阻止转录的一个特定的蛋白质,和在其缺席很容易看到,如果机械地激活电流消失。他们发现FAM38A——改名为Piezo1。3最后最重要的是测试横切Piezo1到其他细胞系,然后获得mechanosensitivity。“这告诉我们,(压电离子通道)不仅是必要的,但也足以mechanosensitivity传输。Patapoutian说。
下一个任务是,看看Piezo1兄弟或姐妹。哺乳动物的基因组比较,他们发现另一个蛋白质,几乎是50%的相同,他们叫Piezo2。和基因组分析还预测压电渠道在许多其他生物,甚至植物和黏菌。
独特的蛋白质
“压电蛋白质与其他离子通道”Grandl说。他们是完全不同的氨基酸序列,蛋白质序列和推测他们的结构。他们看起来一点也不像我们知道的东西,这使他们很难学习。”
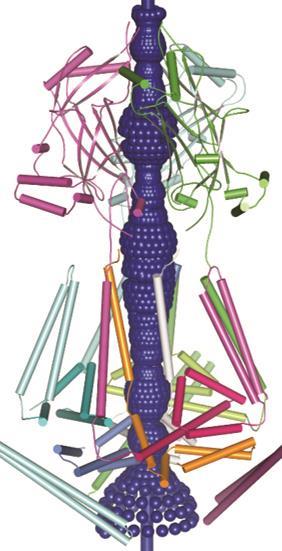
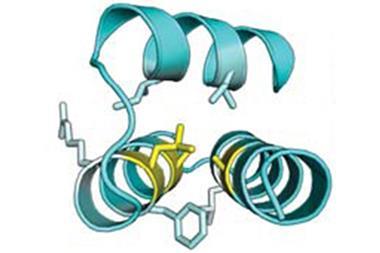
首先他们是独一无二的大小:Piezo1和2都是大规模的蛋白质(氨基酸分别在2521年和2752年),离子通道发现到目前为止,最大的直径在200左右。模型预测在14编织穿过细胞膜的跨膜域,——也比大多数离子通道蛋白。这些特性可能澳门万博公司与它的感官拉伸的机制和机械力,Patapoutian说,但究竟怎么回事还不得而知。
2015年肖白龙在北京清华大学发表了电子显微镜成像的鼠标Piezo1在低温下4进一步提供一些线索的结构。通道形成三聚物的复杂,与中央孔隙包围一个独特的三叶螺旋桨架构。看来离子通过三个亚单元之间的接口与中央孔,一顶帽子有一个不寻常的折叠结构,没有找到其他地方。5
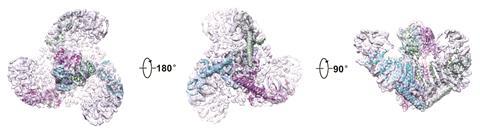
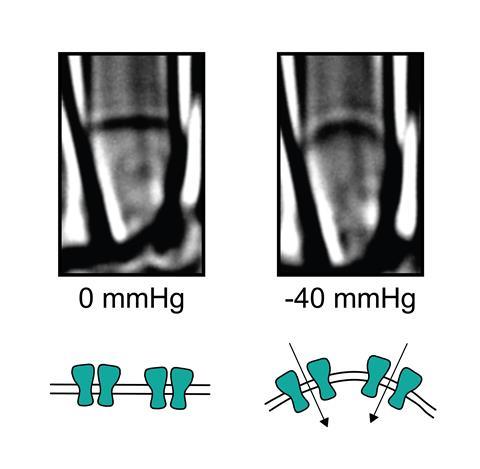
到目前为止,结构信息只是给线索压电渠道打开和关闭。有一个复杂的设备由大的蛋白质分子,但其不清楚哪些部分作为感应触发。蛋白质是否正常的一个问题是独立在细胞膜或如果它是固定在细胞内部脚手架。戈特利布和他的同事们通过创建“水泡”——回答了这个扩展在细胞膜与细胞的内部cyctoskeleton蛋白质Piezo1渠道仍然活跃的地方。6
所以直接从细胞膜蛋白质意义上的压力,这也可以解释他们的大尺寸和膜覆盖,表明Grandl。这可能帮助他们非常敏感膜中发生了什么。一个建议是,压力膜凹陷其厚度,导致“疏水疏水区域的不匹配的压电膜通常坐。这些蛋白质的疏水部分的接触可能会导致蛋白质构象的变化,打开离子通道。
部分挑战是发展中正确的方法来探测蛋白质submolecular水平。我们才开始培养良好的工具,应用机械力量很小,我们谈论的是部队的顺序piconewtons——1000000000牛顿的“Grandl说。他是使用磁性,试图找出哪些部分蛋白质的很多领域都压敏。
Grandl已经设计压电蛋白质包含一个额外的13个氨基酸序列被测试区域内的蛋白质。这个序列可以绑定到75纳米磁性纳米颗粒涂层与链霉亲和素的蛋白质。他可以通过聚焦磁场施加一个力专门在一个蛋白质域同时测量通道的活动。7使用这种方法我们能够扫描整个蛋白质和识别两个域,似乎异常高的机械灵敏度,“Grandl说。其中一个靠近孔隙本身,而是另一个是位于另一端的蛋白质,也Grandl建议可能意味着离子通道与某种遥远的杠杆机制运作。
除了联系
比赛解决难题的离子通道的结构和机制仍在继续,一样的任务理解日益增长,压电蛋白质似乎发挥生物学作用。Piezo2第一次被确定为离子通道调节我们的触觉和proprieception,但它似乎出现在其他感官细胞和所有类型的机械反馈的关键。例如Piezo2似乎参与遥感在肺组织肺段,控制呼吸模式。也参与机制,控制肠道运动,通过血清素释放。甚至被发现在膝盖软骨-似乎哪里有移动部件你会发现压电蛋白质。
Piezo1主要是发现在非感官细胞和器官暴露在流体压力。发现广泛的心血管系统,包括红细胞。红细胞经验大量的机械力,因为他们浏览血管和显然压电传感中发挥着重要作用,调节细胞的体积,根据他们的位置在心血管系统中,“Patapoutian解释道。他说这可能解释血细胞能够挤进狭小的毛细血管。胚胎发育的压电也至关重要,Piezo1发挥作用在血管的生长。小鼠没有它不发展正常的血管系统,将无法生存。
动力学和疾病
压电蛋白质似乎做了很多,但为什么有两个不同版本的蛋白在哺乳动物?从造型数据他们都有类似的结构和压敏和允许多个阳离子通过孔隙类型。Grandl表明Piezo1可能敏感的一个更大的数量和类型的机械部队,而Piezo2更狭隘的调谐专门检测机械联系。为数不多的差异是其失活动力学Patapoutian说。一旦刺激一些离子通道会自动变得不活跃和有效地关闭离子流动,无论继续刺激。有点超过Piezo1 Piezo2灭活,你可以看看这个,说这些不是大差异,但激活动力学实际上是非常重要的。线索来自突变在人类,”他补充道。
自发现以来,许多罕见遗传疾病有关的突变压电蛋白质和其中的一些是由离子通道动力学的变化引起的。如果减速失活机制,这将导致更大的离子流入细胞比要求,称为功能。这是在遗传性疾病遗传xerocytosis,8一种贫血与突变红细胞Piezo1频道。
Gottlieb看着Piezo1活动细胞突变。有显著差异的我们所说的开放灭活状态——原来这是慢慢关闭,所以导致比应该有更多的离子通过。“多余的钙流入红细胞引起下游激活osmotically驱动脱水,使得细胞被破坏,导致疾病。
疼痛
那么痛苦呢?Piezo2渠道提供的触觉的敏感度也扩展到引起疼痛的感觉吗?显然更好的理解有多疼痛发生的优先级列表的人员看离子通道。链接可能不是一个惊喜,但似乎并没有这么简单的关系。当你删除Piezo2蛋白质从神经元,老鼠是完全麻木不仁的轻触,但他们似乎回复正常高强度接触被认为引起疼痛,“Grandl解释道。它非常清楚,原则mechanosensor参与疼痛不是Piezo2神经生物学家约翰·伍德补充道,在英国伦敦大学学院。木头与Patapoutian展示这一点。
当你用锤子敲你的拇指,我们不知道这是什么频道让你去啊
约翰·伍德
但Patapoutian不完全折现任何关系:“陪审团是一点,”他说。这是一个地区他的研究小组正在积极工作。伍德说,可能会有一个链接神经性疼痛,疼痛由于组织损伤,神经纤维可能损坏或不正常的地方。
木头的工作探讨了生理的疼痛感的说法,说痛苦是棘手的,而不仅仅是简单的反应细胞传感器。疼痛是种知觉或感觉在你的大脑,我们不明白。”似乎可能还有另一个机械激活离子通道与更高的阈值调节疼痛,但分子的身份还不知道。“这是令人兴奋的事情,”增加了木头。“当你用锤子敲你的拇指,我们不知道这是什么频道,让你继续哎哟——这就是待价而沽,是一个非常有趣的前景。”
而找到一个新的疼痛受体分子的诱人前景,可以抑制在未来,研究人员一直在寻找分子,可以抑制压电离子通道来治疗的疾病压电蛋白质发挥作用。甚至在蛋白质被确定之前,弗雷德里克(goldman Sachs)和他的团队发现了一个小肽从智利玫瑰蜘蛛的毒液块mechanosensitive离子通道,包括Piezo1。临床前开发的多功能分子作为肌肉疾病的治疗杜氏肌肉营养不良症(DMD)。与漏mechanosensitive离子通道,导致钙流入到细胞导致肌肉退化。通过抑制这些离子通道,可以恢复平衡。
但鉴于其普遍性质,有多大有用压电阻断药物。他们扮演很多不同的重要角色,一个全球性的激活剂或抑制剂可能有许多不同的副作用,”Patapoutian说。
鉴于压电蛋白仅在七年前发现,已经有大量的作品显示出它的重要性远远超过我们的触觉。他们的使用在许多器官说明了生物学的聪明才智和经济。虽然线索开始堆积,压电蛋白质是如何在分子水平上仍然是一个谜。”这将是非常有趣的和令人兴奋的未来10年弄出来,“Grandl说。
瑞秋巴西是一个基于科学作家在伦敦,英国
引用
1 S S Ranade等,自然,2014,516年,121 (DOI:10.1038 / nature13980)
2 h吸引等,Nat。>。,2015,18,1756 (DOI:10.1038 / nn.4162)
3 B Coste等,科学,2010,330年55 (DOI:10.1126 / science.1193270)
4 J通用电气等,自然,2015,527年,64 (DOI:10.1038 / nature15247)
5 Kamajaya等,结构,2014,22,1520 (DOI:10.1016 / j.str.2014.08.009)
6 C D考克斯等Nat Commun。2016年,10366 (DOI:10.1038 / ncomms10366)
7 J吴,R Goyal和J Grandl,Nat。Commun,2016,7,12939 (DOI:10.1038 / ncomms12939)
8 R Zarychanski等,血,2012,120年,1908 (DOI:10.1182 / - 2012 - 04 - 422253血)













还没有评论