米拉Senthilingam
本周,Kiki桑福德使用化学突出有用的生活技能。
Kiki桑福德
生活是平衡。在分子水平上的微调过程允许有机体存活或从人世纷扰陷入死亡。
但是,事情怎么活着防止引爆走向死亡?他们如何保持完美的平衡?
机制,允许小小酵母细胞进行生活最大的大象有很多,但可以说是一个小的行为,适当的分子称为几乎无处不在泛素拥有最广泛的影响。可以肯定的是,细胞分裂泛素相关参与各种各样的人类医学疾病如癌症,神经退化,肌肉萎缩、病毒感染、糖尿病和炎症。
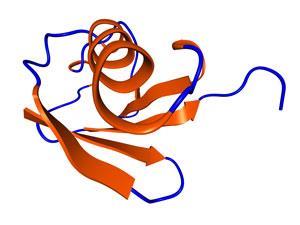
首次发现于1975年在纽约大学的一组科学家由吉迪恩•戈尔茨坦泛素最初叫做无处不在immunopoetic多肽在免疫细胞分化的作用。然而,因为他们发现它无处不在他们看起来从奶牛到芹菜细胞,研究人员认识到,多肽链重达8.5 kiloDaltons可能发挥更大的作用在所有生物体的细胞功能。它不会与任何这些直到两篇论文的出版在美国国家科学院院刊Aaron Ciechanover艾弗拉姆Hershko,和欧文在1980年上涨了。
Ciechanover在2006年的一次采访中,诺贝尔奖获得者和生物化学家,说:“生活是一种平衡部门的增长,并没有增长。突变会导致不平衡,除非修理。泛素参与控制修复和保持平衡。
,这是真的。即使微小的分子称为泛素被称为一次又一次的细胞“死亡之吻”,其目的是更大。泛素解释了一些蛋白质在细胞长寿而其他人只有短暂的细胞内存在,为什么有些蛋白质洪水细胞内部,看到别人都是极其罕见的。蛋白质修饰符,它真正的核心生活如何持久化困难重重通过增加各种方式细胞和生物体可以回应他们的环境。
这76氨基酸化合物的最突出的作用就是它的绰号——泛素标记蛋白质需要破坏或回收。因此,“死亡之吻”。蛋白质标记与泛素链是通过这一过程被称为分解蛋白质水解肽债券被摧毁,一个接一个。
这是一个相当简单的过程被Hershko, Ciechanover(他当时研究生),和玫瑰。现在他们阐明这一过程被称为泛素化或ubiquitinylation,与泛素标记的蛋白质。
从1978年到1983年,研究人员发现,泛素化是由ATP,使酶激活泛素E1,第二个叫做E2配合ubiquitin-E1复杂的酶,它允许第三个创造性的标题叫做E3泛素连接到目标蛋白质。在最后一步,E3是负责识别的分子底物蛋白质和催化反应。
有上百E3分子可用于目标特定的蛋白质在细胞和在需要的时候。生物也有35 E2酶。但只有一个泛素。这个层次的简单优雅蛋白质系统掩盖了它的重要性。
泛素如何绑定可能有特异性调节数以千计的蛋白质参与几乎所有细胞从细胞周期蛋白降解,跨膜受体走私、DNA修复、基因转录、细胞凋亡,以及更多的吗?
这是事情真正开始变得有趣的地方。看来的泛素分子链决定标记蛋白质的命运。所以,泛素化的过程有时会停在一个周期的结束。这叫做monoubiquitination。有时这个过程重复一次又一次地导致一个链,包括多个泛素根,所有相关的isopeptide糖基之间的债券未来泛素线和赖氨酸包含在前面的分子。
泛素包含七个赖氨酸残基,称为转K6 K11, K27, K29, K33, K48, K63因为位置的分子。这允许一定的灵活性,扩大泛素的标签功能。例如,链链接通过K48残渣负责发送蛋白质降解。其他联系,如K63,可能涉及到其他进程,像DNA修复。
当前的假设是泛素链长度和连接类型赋予特定的拓扑结构复杂,创建与目标蛋白质。这就决定了其他分子相互作用。例如,有可能是长链留在蛋白酶体不再允许更完整的退化。
正如你所看到的,我们现在知道,有多层泛素蛋白可以授予修改系统中特异性。很难相信,40年前,我们不知道什么是泛素。
在1950年代之前,细胞蛋白被认为是稳定的东西在身体不需要做特定的工作,如果有的话,维护。然后在1942年,哥伦比亚大学通过鲁道夫Schoenheimer阐明人体的概念,细胞,其组成蛋白质的动态系统需要不断的变化。通量,而不是稳定成为常态。
细胞如何处理内部和外部力量的不断起伏,和分解蛋白质,当它需要清洁房子吗?
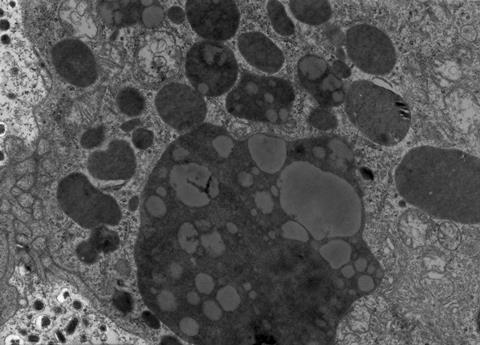
溶酶体被发现在1950年代由基督教de Duve和细胞垃圾处理提供了一种途径。然而,他们并没有完全符合要求。事实上,溶酶体降解的蛋白质无法解释:为什么不同的蛋白质在细胞不同的半衰期;为什么退化似乎与生理参数的变化,如酸度、营养的可用性,或细胞增长阶段;也不为什么溶酶体抑制似乎并不影响一些蛋白质的数量。
最重要组成部分,蛋白质降解溶酶体假说不能解决能源需求不断出现。消化酶在溶酶体中发现不需要任何额外的能量来溶解蛋白质。然而,经常在细胞内ATP矩阵需要完成分解过程。
分子称为APF1,或交替ATP-dependent蛋白水解作用因子- 1,通过Hershko科普的趋势在70年的研究蛋白质是如何形成的,但灵感来源于这些有点被忽视和异常发现ATP依赖的蛋白质降解。APF1后来被确定为泛素,Ciechanover Hershko,和玫瑰,去世在2015年8月,被授予2004年诺贝尔化学奖的工作进行了1970年代和80年代发现ATP-dependent ubiquitin-mediated蛋白质降解。
当时他们不知道他们的工作是多么重要对我们理解细胞生物学。年后,我们取得了巨大的进展,但我们才刚刚开始泛素的表面,以及这种迷人的系统控制,反过来控制生命的平衡。
米拉Sethilingam
科技作家Kiki桑福德与泛素的调节化学。下周,我们藐视规则的化学。
Kat Arney
因为高温影响的结构至关重要的生物分子,如DNA和蛋白质,研究人员认为生存上限的最难处理的细菌约为73°C。挑战的人的想法生活不能把热量是生物学家,托马斯·布鲁克。
米拉Sethilingam
找出在下周的结果化学的元素。在那之前,谢谢你的倾听。我是米拉Sethilingam。














还没有评论