超快红外光谱探测了HF中短而强的键的性质2- - - - - -
1919年5月,一名化学本科学生莫里斯·哈金斯加州大学伯克利分校的学生都陷入了恐慌。哈金斯的教授威廉·布雷(William Bray)要求他的学生必须写一篇学期论文才能通过他的课程,但哈金斯还没有这样做,最后期限就要到了。无奈之下,他把布雷讨论过的一些“化学未解问题”的粗略笔记拿给布雷看。教授会接受这些笔记作为学期论文,并加上标题吗?
布雷这样做了,但有一些警告。“哈金斯,”他说,“这篇论文中有几个有趣的观点,但有一个你永远不会让化学家相信,那就是一个氢原子可以同时与另外两个原子成键。”1哈金斯提出了这个奇怪的想法,利用化学键的电子共享理论吉尔伯特·刘易斯,描绘了,例如,氟化氢的二聚体,其中四个原子排列在一个正方形中,每个氢原子与两个氟键合。然而,刘易斯对整个观点持怀疑态度。
通常情况下,年轻的研究人员更愿意接受老科学家抵制的新思想。这是在1920年温德尔·拉蒂默他是伯克利分校的一名年轻讲师,现在是博士后值得Rodebush发表了一纸在这篇文章中,他们列出了哈金斯的建议,并在脚注中赞扬了他。2但这种奇怪的联系直到刘易斯自己在1923年的开创性著作中被说服后才有了名字原子价与分子结构“,“对我的价电子理论最重要的补充在于提出了众所周知的氢键。”
一个世纪的争论
但拉蒂默和罗德布什的提议在至少10年的时间里基本上被驳回或忽视了;1926年英国化学家亨利·阿姆斯特朗1921年,他嘲笑氢可以充当“重婚者”的想法欧文·朗谬尔提出一个稍微不同的观点来解释水和氟化氢等分子是如何形成二聚体的。对氢键的接受是有帮助的莱纳斯鲍林.在1925年和他的研究生的一篇论文中英镑亨德里克斯,他展示了这种键是如何解释离子HF的2- - - - - -氢被夹在氟原子中间。鲍林1939年的书化学键的性质将氢键巩固为化学家词汇的一部分,尽管他在将氢键视为离子之间的纯静电现象或离子和共价形式之间的共振之间摇摆了一段时间。不仅是鲍林的地位,他还将其与晶体学数据联系起来。
李纳斯·鲍林(Linus Pauling)的介入有助于人们接受氢键。在1925年与他的研究生斯特林·亨德里克斯(Sterling Hendricks)合著的一篇论文中,他展示了这种键是如何解释离子HF的2- - - - - -氢被夹在氟原子中间。鲍林1939年的书化学键的性质将氢键巩固为化学家词汇的一部分,尽管他在将氢键视为离子之间的纯静电现象或离子和共价形式之间的共振之间摇摆了一段时间。不仅是鲍林的地位,他还将其与晶体学数据联系起来。
鲍林的不确定性是可以理解的;尽管氢键在去年庆祝了它的百年诞辰,但关于氢键的争论仍然没有停止。学生们现在通常知道氢键本质上是静电:一个正极化的氢附着在一个吸电子实体(如氧或氟)上,被另一个分子上的电子孤对所吸引。但它已经长认可氢键中也有共价。3.液态水中的氢键比H中的共价键弱25倍2O分子,其他的,像HF2- - - - - --更强、更短,通常被认为是离域的、非经典的三中心键。
引爆点
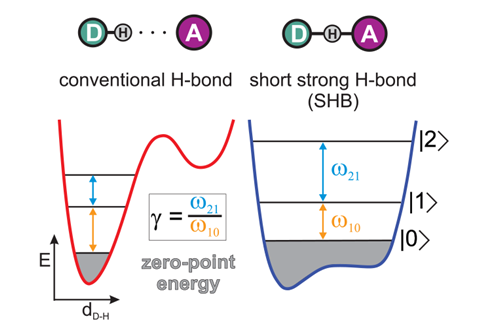
后一个键的特点是它可以变得对称,氢位于氟原子的中点。虽然这在几十年前就被承认了,但这种债券仍在被争论,作为一种最近的一篇论文通过安德烈Tokmakoff芝加哥大学的研究人员和同事证实。4他们使用超快二维红外光谱来表征HF中的键2- - - - - -在水溶液中,可以看到一个平滑的交叉,从传统的氢键(氢不对称地定位,共价键到一个氟)到一个“短而强”的氢键,其中氢占据一个浅的双势阱。在后一种情况下,键接近完全共价的性质,但在混合其弯曲和拉伸运动的方式中是强烈的非调和的。
在极端情况下——实验和计算都表明,氢的寿命很长——氢平均位于氟离子之间的平底单孔电位中。在这里,氢键和共价键之间的区别消失了:正如作者所说,短而强的氢键位于“氢键结束和化学键开始的临界点”。
同样的结构原则上也存在于所谓的Zundel离子H中5O2+氢离子可以在水中形成(哈金斯也在1971年承认了这一点)。但在那里,它的寿命非常短,而且光谱学更复杂。更重要的是,即使在室温下,双势阱结构中桥接质子的量子力学隧穿也变得非常重要,因此Zundel离子只能用完整的成键量子描述来正确描述,而不能用经典的静电学或电子共享概念来描述。5
换句话说,至少在这里化学被证明是一种物理的粗粒化。它从量子糖蜜中提取出有用的启发式概念,如共价、静电和氢键。但有时你只需要蘸着糖蜜就行了。
参考文献
1 D Quane,公牛。嘘。化学。, 1990,73
2拉蒂默和罗德布什,j。化学。Soc。,1920,42, 1419 (doi:10.1021 / ja01452a015)
3 S J格拉博斯基,化学。牧师。, 2011,111, 2597 (doi:10.1021 / cr800346f)
4 B德瑞卡et al。,科学, 2021,371, 160 (doi:10.1126 / science.abe1951)
5 F穆哈特et al。,j .化学。定理。第一版。, 2017,13, 2400 (doi:10.1021 / acs.jctc.7b00017)







1读者的评论