印度化学家发表了他们说这是蛋白质中氢键与四价碳原子结合的第一个证据.位于布巴内斯瓦尔的国家科学教育与研究所(Niser)的Himansu Biswal团队在现有的蛋白质数据库(PDB)晶体结构信息中发现了1051种这样的非共价相互作用。
比斯瓦尔说,尽管这种最强的相互作用与传统的弱氢键不太匹配,但它们可以帮助蛋白质结合它们的底物manbetx手机客户端3.0.他说:“如果大量存在,累积效应可能大到足以控制蛋白质的结构和功能。”
这一发现令人惊讶,因为这些氢键的起源和性质与传统的氢键非常不同。在这种相互作用的一边,通常有一个氢键供体——即一个氢原子,附着在一个像氧这样的电负性原子上。通常,氢键受体也是电负性原子,电子为孤对或在多键π轨道中。但对于作为氢键受体的碳原子来说就不是这样了。氢键供体通常也不附着在电负性原子上。
在电负性尺度上,碳的电负性值为2.55,与氢的电负性值2.2非常相似。研究小组成员Juhi Dutta说,人们可能因此认为它不能收集足够的电子来成为氢键受体。但近年来,科学家们已经证明甲烷中的碳原子,既没有孤电子对,也没有π电子,可以是氢键受体。然而,没有人在蛋白质晶体结构中寻找类似的相互作用,多亏了PDB,蛋白质晶体结构是一个丰富的潜在数据来源。
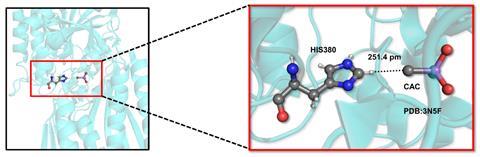
使用自制的代码,Niser团队在PDB中搜索非共价相互作用,包括四价碳连接到正电元素,如砷。砷贡献的额外电子使碳原子成为氢键受体。Niser的Akshay Kumar Sahu解释说,搜索使用了两个关键标准。首先,碳原子和氢原子之间的距离必须超过它们通常的范德华半径之和,范德华半径定义了未成键原子之间的距离。第二,氢原子,与它形成共价键的原子,而碳原子的氢键受体必须在一条直线上排列。
研究人员在918种不同的晶体中发现了1051种相互作用。843个晶体在四价碳氢键受体和氢键供体之间存在相互作用,其中氢连接在碳上,而不是电负性更强的原子上。
玛尔塔Mosquera西班牙Alcalá大学的一名研究人员表示,“这项研究令人信服地证明了在蛋白质等复杂系统中存在与四价碳的h键”。她补充说,这可能会鼓励研究人员“重新审视其他反应机制和生物过程,以探索这些不那么弱的相互作用的影响”。
Biswal的小组现在想用高分辨率激光光谱学为这些氢键提供实验证据。他们还希望找到生物分子也含有二氮键的证据,二氮键涉及富电子碳原子和缺电子碳原子之间的非共价相互作用。
参考文献
J Dutta等,j .化学。正无穷。模型。, 2022, doi:10.1021 / acs.jcim.2c00015











1读者的评论