灵活性和创造力帮助克服各种意想不到的困难
自然产生令人难以置信的各种各样的环状化合物,小环丙烷和环氧化合物,巨大的50个原子或更多的重点。然而,更熟悉的五年和六元环仍是迄今为止最常见的天然产品。这不是太奇怪,因为这些占据了一个特殊的“金发姑娘”空间,更紧张比他们的更大或更小的堂兄弟。这使得它们更容易合成(无论是通过化学家或酶)。
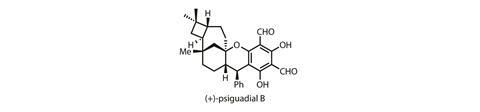
四元环尤其常见,自然有好的选择一起把这些弹簧周期相对较少,大部分使用阳离子反应或环加生物合成。不幸的是,事情并不更容易合成化学家。在实验室里,环加是目前最安全的选择,但它并不总是容易获得所需的替换,立体化学或区域选择性。如果一个环加成作用不会,化学家必须有创造力,莎拉·赖斯曼和加州理工学院的同事,我们在不寻常的天然产物的合成psiguadial B。1
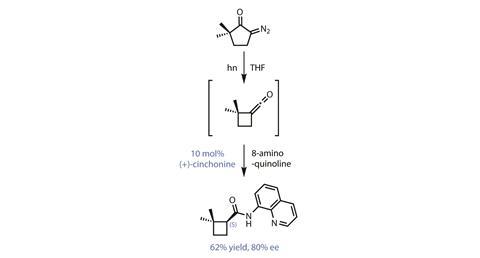
该集团的大胆的策略是首先创建环丁烷,用人的沃尔夫环收缩diazocyclopentanone(图1)。这个用一些聪明的不对称耦合organocatalysis提供手性环丁烷构件具有良好的选择性。然而,这令人印象深刻的串联反应实际上给了错误的对映体。不幸的是,到目前为止最好的organocatalyst不对称烯酮除了生物碱弱金鸡纳碱。只有一个对映体弱金鸡纳碱发生自然,所以团队不能简单地使用配置的相对扭转选择性催化剂。
然而,其中一个原因,辛可宁是一个受欢迎的选择是异构催化剂发展自然产物金鸡纳啶往往要表现得好像自己是弱金鸡纳碱的对映体(它并不完全,所以它被称为pseudoenantiomer)。遗憾的是,在这种情况下,金鸡纳啶反应完全不同,选择性低很多。
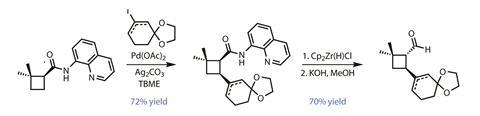
而不是重新设计的路线提供正确的立体化学,团队改变了策略和开发计划翻转到正确配置后的合成。集团新安装的氨基喹啉酰胺直接使用palladium-catalysed碳氢键乙烯化作用(图2),增加一个保护cyclohexenone集团到环丁烷环酰胺cis。减少醛和酰胺基取代基允许添加到更稳定的反式构型翻转,整齐地反相的有问题的立体选择性。
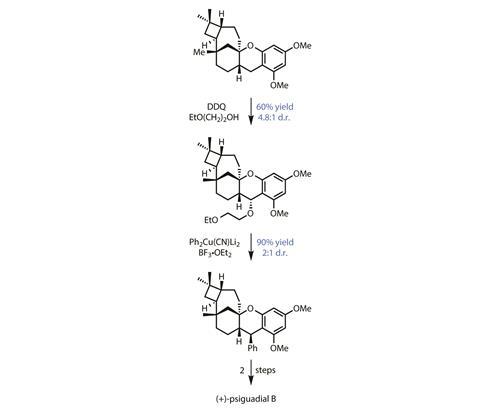
从这里,七步骤完成五环的核心结构的自然产品,团队剩下只是苯和醛组安装。他们选择用一个碳氢键functionalisation加快速度。首先,氧化极负电子苄基的碳安装一个临时醚组(图3),然后与苯基取代铜酸盐把最后一环。最后,裂开甲基醚和二甲酰化完成目标。
由于集团的决策应对挑战trans-cyclobutane环系统的合成,并明智地利用天生的碳氢键反应加快碳碳键形成的步骤,这个棘手的总体目标是在15步骤完成。
引用
L M查普曼et al, j。化学。Soc。2016年,138年,9803 (DOI: 10.1021 / jacs.6b07229)







1读者的评论