卡尔·柯林斯赞扬简化添加硅与KOtBu杂环化合物
在硅可能是最熟悉有机合成作为保护团体的一部分,其效用延伸得更远。的彼得森烯化作用,Mukaiyama醇醛反应和Fleming-Tamao氧化的只是一些行之有效的转换。
自2000年代初以来,(杂)芳硅醇和硅烷已经开始被用于metal-catalysed交叉耦合。虽然硼试剂的经典地位Suzuki-Miyaura反应不太可能很快消失,大部分硅的低成本和广泛的可用性,和最近的怨言的genotoxity表明硼硅积木还很可能有未来。
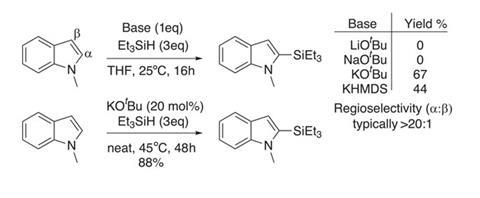
这成为现实,我们需要简单的和具有成本效益的获得甲烷硅基化的芳烃。传统方法使用metallated芳烃和硅亲电试剂都固有的局限性与强大的基地,并生成化学计量的大量浪费。使用罕见的过渡金属催化方法silylate芳烃和heteroarenes新兴,和之间的合作布莱恩Stoltz和罗伯特·格拉布在加州理工学院的,我们已经采取措施向一个更理想的合成协议。1
这个团队开发了简单的协议dehydrogenative碳氢键甲硅烷基化与hydrosilanes众多杂环化合物,使用催化钾叔醚作为唯一的试剂。初始优化研究使用N甲基吲哚和triethylsilane确定一个钾阳离子对调解的反应是至关重要的。的叔醚盐似乎给最好的反应性和产品产量(图1),和团队成功的几个负电子N保护与一系列hydrosilanes吲哚。
不幸的是,吲哚本身和缺电子系统稳定,排除许多常见nitrogen-protecting组。幸运的是,苄,methoxymethyl缩醛(妈妈)和2-trimethylsilylethoxymethyl (SEM)保护系统提供免费的机会- h。
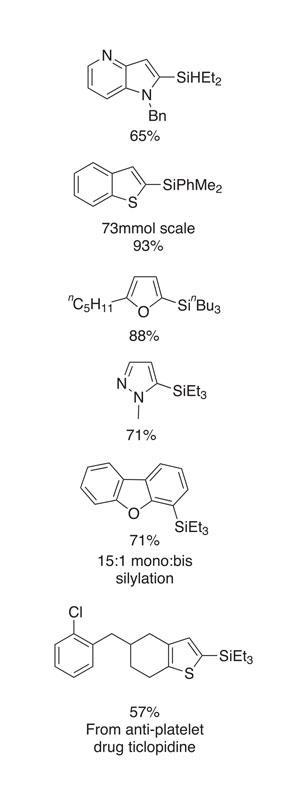
反应通常进行有效——尽管底物范围出发,和一个分子间反应评价,只显示适度的官能团容忍。芳基氯化物,烯烃和炔烃是有用的组容忍,叔胺和pyridine-type氮原子,一个工业相关的设置。该方法也适用于各种各样的杂环化合物(图2)。在别人,这包括噻吩、苯并噻吩、呋喃和N烷基化摘要。
一些机械的投机团队包括也很迷人。他们明智地没有典故对一种碳氢键活化机制,2和他们的初始实验表明自由基的参与。当游离基清除剂节奏包括TEMPO-SiEt吗3加合物形式,表明甲硅烷基自由基的存在。然而,尽管这个观察,一个简单的(Minisci类型)激进的替换似乎不太可能。缺乏电子杂环化合物如吡啶和喹啉-此类反应的主要基质失败。
痕量金属分析和研究范围的商业和准备tBu来源似乎排除了过渡金属催化反应的痕迹。反应的选择性(vsß)似乎排除了一个亲电取代机制,和化合物的芳香性似乎也无关紧要。研究小组指出,所有的证据都指向一个不同的机制functionalising heteroaromatic系统——这将是有趣的,看看heteroaromatic激进的物种有一个角色要扮演。
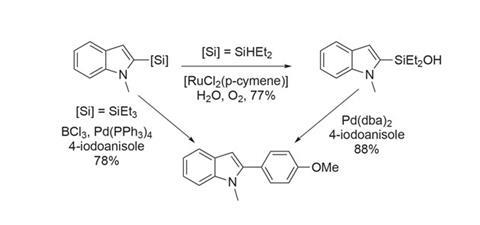
虽然有局限性的官能团容忍和应用程序更复杂的分子,这样容易获得甲烷硅基化的杂环化合物是非常有用的。产品可以加上芳基卤化物直接或通过硅醇(图3)。硅烷合成的多功能性意味着这些产品并不局限于交叉耦合化学及其在有机材料和药品潜在的使这项工作更加有趣。
卡尔•柯林斯(@karlDcollins)领导一个药物化学实验室在德国
引用
1一个Toutov等,自然,2015,518年,80 (DOI: 10.1038 / nature14126)
2图德博土和D P伦,Angew。化学。Int。。,2011,50,5018 (DOI: 10.1002 / anie.201101597)










还没有评论