公司令人信服管理者,但医生会使用它们,提供者会支付费用吗?
阿尔茨海默氏病抗体处理升级状态完全核准基础是反模类抗体获批后收到的更多实验数据加速批准一月.
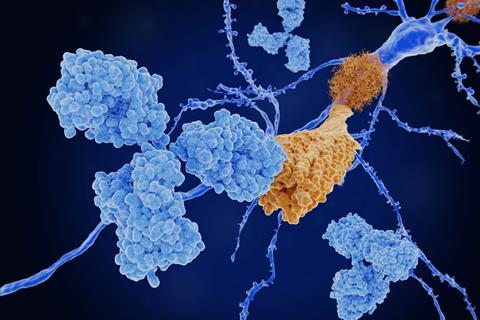
表示该药现在可以通过美国国家Medicare保健计划提供,
同时 实验结果Eli Lily相似抗体danemab显示相似能力清除amyroid从病人脑部, 并减慢他们在老年痴呆早期认知下降公司现在将申请美国监管审批
这些结果绝对令人鼓舞。药效干预能对大规模削弱功能的疾病产生可测量效果也值得深思, 这些药提供适量减慢疾病(远方)不可避免的进步-在18个月试验中短短数月-它们不是解药 无法扭转认知能力的损失
成本相对较高,无论是经济成本还是医疗资源成本都较高。需要每月静脉注射,必须定期监控病人副作用,包括进行脑扫描检查肿化或出血
生物元和Eisai似乎说服美国食品药管局(FDA),未来数月和数年将判断医生和包字符串持有者是否同意福利证明行政、财务和副作用负担合理
观察世界其他地方监管者 Lecanemab 和后续抗体欧洲药品局(EMA)比美国对口机构更谨慎考虑生物-Eisai第一代阿尔茨海默抗体.林业局允许Aduhelm上美市场2021年(承认加速审批路径下各种限制)EMA以缺少充分利益和Biogen拒绝撤销应用请求批准归根结底,它有效无法说服医生s和保健提供方有其价值
Lecanemab和Donanemab的临床实验数据肯定比aducanumab强和可信,但临床效益仍然微小,副作用威胁仍然存在同往常一样,归结为利益与风险平衡

Phillip作为商业编辑的目的是向读者强调商业界正在展开的振奋和创新化学活动,并让他们了解化学界的趋势和动态
视图全剖面










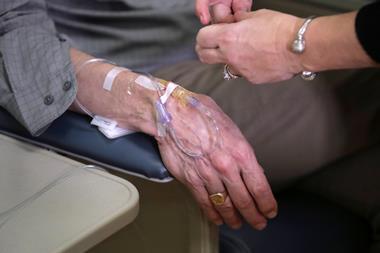



尚没有备注