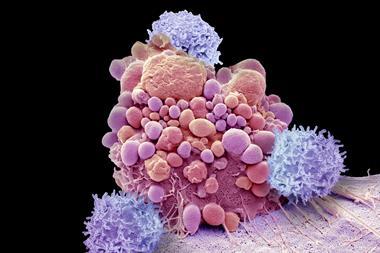
食品药管局透露调查一场革命性癌症疗程的严重副作用.机构宣布T细胞恶意报告 接受CAR(奇异抗原受体)-T细胞疗法CAR-T常为血液组织癌症患者提供最后治疗
CAR-T要求取取病人T细胞并用病毒向量修改受体基因
CAR-T要求工程T细胞在实验室中成长并重新注入原创捐赠者改型T细胞受体嵌入目标蛋白并杀癌B细胞前两个CAR-T疗法2017年在美国获得批准治疗血癌
病人没有治疗选择通过CAR-T疗法治愈引起极大兴奋,尽管费用可超过350 000美元(260 000英镑)/每次处理
FDA表示它收到了T细胞恶性病临床试验和售后报告风险适用于目前所有核准的CAR-T理疗,并得出结论
表示正在调查T细胞恶性风险并产生严重结果, 包括住院和死亡, 并评价管制行动的必要性
局列六批产品调查安倍玛并布雷扬济市布里斯托尔·迈尔斯·斯奎布叶卡塔并特卡图斯KitePharma/Gile卡维克蒂强生公司并金字塔诺华州
二次癌症发生后使用扁豆或抗反转录病毒修改T细胞脱氧核糖核酸的可能性长期以来一直引起关注。早期诊断性免疫机能失常时 治疗性抗反转录病毒媒介将遗传素插入支持癌症基因引起类似白血病.
CAR-T理疗中一种可能机制是激活靠近病毒集成点的癌症基因米歇尔萨德兰CAR-T纪念SloanKeving癌症中心先驱赛德兰和同事上报今年早些时候T细胞修改中断调节基因可释放离散T细胞扩散并发近学习剖析扁豆和抗反转录病毒如何影响CAR-T细胞产品
值得注意的是更多新报告案例使用扁叶向量多于g-抗反转录病毒向量,重要机制考虑 遗传偏向 某些个人
林业发展局初步批准CAR-T要求公司跟踪病人15年,并进行观察研究评估二次恶性反应的长期安全风险FDA表示:「接受这些产品治疗的病人和临床试验参与者应终生监控新恶性
Gilead表示,它在临床试验和商业环境治疗了17 700名病人,并不知道有任何证据表明Yescarta或Tecartus引起恶性反应Nivartis和Bristol-Myers Squibb发布类似声明,表示CAR-T疗法和二级癌症之间没有因果联系
电阻药店上报搜索FD不良事件发现共12T细胞淋巴虫案例,涉及Breyanzi、Carvykti、Kymriah和Yescarta
公告令我们大吃一惊数以百计的病人用CAR-T细胞治疗,约0.1%案例的二次癌症发病率不应终结CAR-TA法光辉未来
问到可以做些什么来减少二次癌症风险时,他说 : `我们需要识别机制以预防二次癌症可行步骤之一是筛选先存变异,可促进烟文学和T细胞扩展
















尚没有备注