过程可以帮助发现材料,利用特定的蛋白质的功能,如药物分子或生物催化剂
美国研究人员已经使用DNA指导蛋白质是如何打包成单个晶体。技术揭示了三个新的蛋白质晶体的安排,展示它如何可以帮助发现新的结构工程材料,利用高度特定的蛋白质的功能,如药物分子或生物催化剂。
蛋白质是复杂和动态的大分子很难强迫成单个,atomically-ordered晶体。然而,蛋白质晶体是理解蛋白质结构和功能所必需的。
问题是补丁的蛋白质表面之间的相互作用,通常开车结晶薄弱,复杂,非共价和缺乏特异性。这使得研究人员很难预测和控制结晶过程以及形成的晶体类型。
为了解决这个问题,乍得墨金的西北大学实验室利用DNA驱动蛋白质结晶,而不是正常的蛋白质-蛋白质之间的关系通过可被识别的和简单的交互与蛋白质表面。DNA相互作用的优势,他们的强度、长度和特异性可以通过碱基对的编程,并预测基因字母:用T C与G。
蛋白质结晶是就像试图建立宜家家具没有说明书,“墨金解释说。件必须完全贴合在一起为了保持稳定,但没有指导很难知道哪些应该去的地方或者你甚至最终得到正确的最终结构。通过使用DNA,墨金的方法提供了信息,类似于一个说明书,指导蛋白质到特定的位置控制。
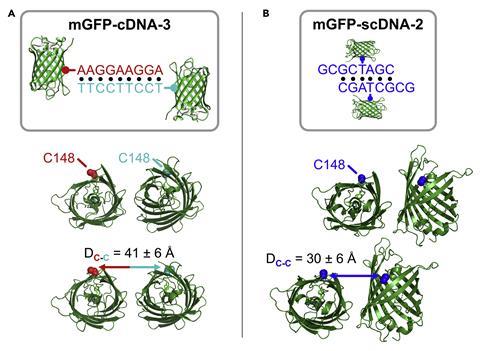
研究人员测试了使用绿色荧光蛋白模型技术。这是做成两个突变版本具有残留的氨基酸半胱氨酸在每个突变体在不同的表面位置。这意味着工程DNA链可以锁在半胱氨酸蛋白质并与之交互。
几个不同的DNA链进行了测试序列,长度和位置,说明蛋白质的安排在单晶是改变不同取决于DNA设计与已知蛋白的晶体结构。更重要的是,研究小组发现了三个独特的晶体结构。
“我们感到惊讶,就连小改变DNA的设计——例如,改变DNA相互作用从六个碱基对长度的九个碱基对,改变了蛋白质包成晶体,“墨金说。这是意想不到的,因为这种变化在DNA是相对较小的规模相比,蛋白质和显示敏感蛋白质结晶是这种干预。”
拨号的特定DNA相互作用的设计在一个可编程的水晶包装提供了一个优雅的解决挑战隐含在外界蛋白质,”评论莎拉•鲍曼,探讨生物分子结晶在布法罗Hauptman-Woodward医学研究所,我们。”这将是有趣的,看看这个技术可以修改用于其它non-model蛋白质系统”。
引用
P醋等,化学,2020,DOI:10.1016 / j.chempr.2020.03.002








还没有评论