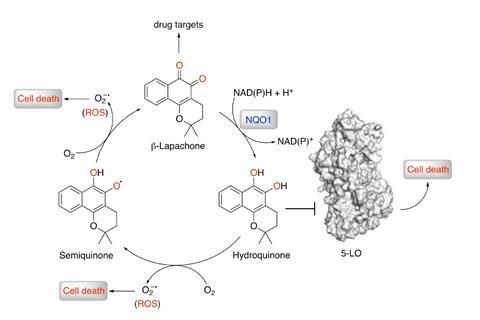
计算机和化学家的友好相处已经有很长时间了。但当涉及到药物发现时,目前的计算方法往往过于冗长和低效,无法确定药物的作用机制。现在,一个多学科研究团队认为,人工智能可以帮助药理学研究。该团队的新方法成功地确定了一种有效的5-脂氧合酶抑制剂,这种酶在一系列人类肿瘤中过度表达。
确定候选药物如何与靶标相互作用以治疗疾病是药物开发的关键。“(这)是药物发现的瓶颈,通常是通过蛋白质组学方法来完成的,这往往是非常费力、耗时的,并且不能保证成功地将药物靶点结合与疾病的调节联系起来,”解释说Goncalo伯纳德他是英国剑桥大学的研究人员,也是这项研究的主要作者之一。他解释说,人工智能“也提供了需要实验证实的研究假设,但是以一种更快、更经济的方式”。
合著者蒂亚戈罗德里格斯他说,机器学习可以远远超越更经典的分子对接。他说:“(我们的)工具不依赖于蛋白质的结构,所以它可以应用于分子对接可能不依赖的情况。”这种新的人工智能工具也更快,因此更便宜。他补充说:“对接的计算成本往往很高,而我们可以在不到10分钟的时间内对一个分子与数千个药物靶标进行分析。”
贝尔纳德斯和他的团队依靠一个巨大的化合物和药物靶点数据库来“教”一台台式电脑。研究人员使用了两种不同的机器学习方法:“一种给出绑定/不绑定的答案……另一种使用几个决策树来预测亲和值,”贝尔纳德斯解释道。然后,算法给出了预测结果。在这种情况下,它提出了天然产物的可能目标β-lapachone-其中包括5-脂氧合酶。“机器学习使我们能够利用数据中的统计模式,”解释说艾伦Aspuru-Guzik多伦多大学(University of Toronto)的人工智能研究人员和萨帕塔的计算这是一家专注于量子计算算法的初创企业。他解释说:“当存在高质量的数据集时,机器学习可以更快、更便宜地为这些现象建模……加速发现新药物的努力。”
该团队的化学家还合成了一组8个β-拉帕酮类似物,并测试了它们与5-脂氧合酶的结合亲和力。然而,没有一种药物的抗癌活性优于β-拉帕酮。算法找到了一个完美的匹配。这突出了生物活性的结构和替代模式的重要性。为了进一步分析β-拉帕酮是如何与目标酶结合的,Bernardes和同事们创建了酶模型,并进行了计算研究,以证实他们在实验室中发现的结果——β-拉帕酮与酶的活性位点强烈结合。
Benjamin Sánchez-Lengeling是Aspuru-Guzik实验室的博士候选人,他说未来“人工智能将成为寻找和开发新配体和候选药物的关键”。由于这些新技术,化学实验室几乎肯定会发生变化。“人工智能将被整合到各个方面:模拟、实验计划和特征描述,”Sánchez-Lengeling补充道。贝尔纳德斯对此表示赞同:“我们已经将(我们的人工智能方法)应用到其他四个项目中,其中一个相当先进。”










暂无评论