有史以来最高的分辨率测量为争议中的运动提供了答案
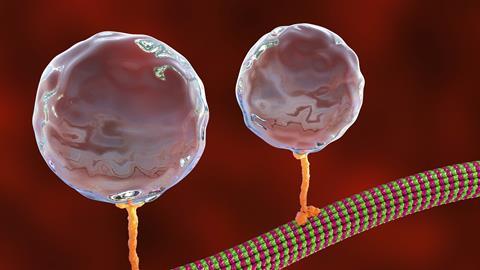
德国的研究人员通过让运动蛋白驱动蛋白携带锗纳米球,比以往任何时候都更详细地追踪了运动蛋白驱动蛋白的步骤。
运动蛋白在许多活细胞中起着至关重要的作用,包括在人类的细胞中,像拖动货物一样neurotransmitter-filled囊泡沿着微管轨道。运动蛋白用皮牛顿力拉动埃里克·谢弗Tübingen大学的研究结果将其比作作用在巧克力棒上的万有引力的百万分之一。
1993年,科学家们首次将光镊子聚焦在附着在运动蛋白上的硅珠上,以测量它们所受到的力。分解一个生物燃料三磷酸腺苷(ATP)分子可以使蛋白质向前移动8纳米。后来,研究人员声称看到了4纳米的子步骤,但其他人不同意。“我们的目标是问,我们能否突破极限,真正正确地解决这些子步骤?”Schäffer回忆道。
大的硅珠上的阻力很大,最终限制了光镊测量的时间和空间分辨率。但较小的珠子散射的光较少,需要更强的激光来产生足够的光力来抵消电机的力。Schäffer说:“然而,如果你这样做,你就炸了分子。”
他的团队转而使用锗纳米球。锗具有非常高的折射率,使其能够从较弱的激光中捕获更多的光动量。但他解释说,以前制造锗纳米颗粒的方法无法生产出尺寸一致的球体Swathi Sudhakar他目前就职于英国帝国理工学院。因此,在Schäffer团队的博士研究期间,Sudhakar开发了一种通过还原氧化锗来生产规则尺寸、直径为70nm的球体的方法。
在纳米球表面覆盖一层脂质双分子层以模拟囊泡后,研究小组将它们与驱动蛋白结合。使用光镊检测运动和力,他们发现每个ATP水解确实有两个4nm的子步骤。
改进后的测量方法还带来了一个惊人的发现。Schäffer说:“人们认为电机在负荷过大时会与微管分离,但事实并非如此。”当受到阻碍时,驱动蛋白马达并没有从它们的微管中分离出来,而是在再次开始移动之前以非常快的8纳米的速度向后滑动。
Schäffer认为,通过采取两个较小的子步骤,而不是一个较大的子步骤,驱动蛋白可能会最大限度地将ATP水解的化学能转化为机械功——尽管还需要进一步的实验来找出这是如何工作的。化学家开发分子机器他建议说,可以借用这个技巧。
评论称,锗小型探测器“揭示了有关动能马达运作的前所未有的细节”创作Duwez他在比利时列日大学研究分子的机械操作。“我们可以期待,这一突破将为破译其他分子机器的运作提供新的可能性,并回答一些关键问题,如:它们是如何被调节的?是什么限制了它们的速度和效率?她指出,合成分子机器产生的力比生物机器更高,她对锗纳米球和光镊子是否能在这种情况下工作感兴趣。
参考文献
年代Sudhakar等,科学, 2021, doi:10.1126 / science.abd9944









暂无评论