当酰胺的形状,一个全新的世界的不对称醇醛反应打开,卡尔·柯林斯说
当我想到不对称羟醛反应,脑海中立即使用硼控制烯醇化物几何和传授面部选择性的手性助剂添加步骤。如果我试着稍微难一点,Mukaiyama醇醛使用化学合成甲硅烷基烯醇乙醚,与面部的控制手性路易斯酸,从更深的深处,我的记忆中。然而,是罕见的催化醇醛化学进行了外观。
Masakatsu Shibasaki日本东京大学开发的第一个直接催化醇醛反应——一个不使用预制烯醇化物——1999年。1而重大的努力已经消耗从那时起,这一事实auxiliary-based反应仍然广泛的主导领域表明很多仍是取得进展。
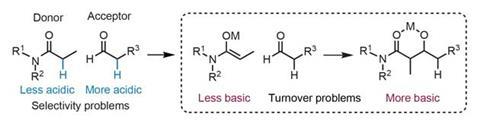
催化醇醛反应面临两大挑战(图1):首先,醇醛捐赠者必须选择性地转化为所需的烯醇化物,通常在存在更酸醛受体。这种广泛的限制范围的醇醛捐助者相对酸性的醛和酮,用更少的酸性羰基-尤其是酰胺很少出现。第二,反应产品比开始更基本的材料。产品强烈坐标路易斯酸催化剂,捕获并抑制营业额。此外,必须抑制逆反应一旦产品被释放。
一个直观的方法来选择性地形成amide-derived烯醇化物会让他们通过添加吸电子集团酸性更强。但是一个团队,由Shibasaki和Kumagai直,开发了一个有趣的选择。2而不是利用的电子属性酰胺提高酸度enolisable质子,他们诱导构象限制使用外部路易斯酸醇醛捐赠。这使得潜在的酰胺烯醇化物酸性,允许适当的选择性去质子化的存在醛受体。
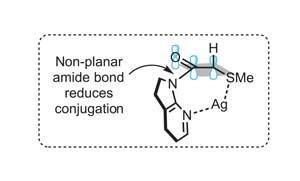
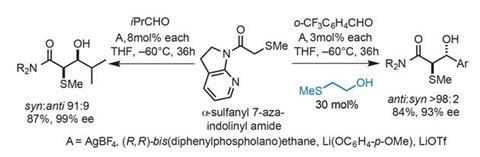
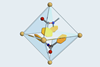
使用alpha-sulfanyl 7-azaindolinyl酰胺醇醛捐赠者,他们建议引入AgBF4形成了一个七人双齿螯合结构(图2)。这两个倾斜indolino集团减少酰胺接合,并将相应的碳氢键p轨道的羰基,进一步增强其酸度。使用这种方法的团队已经成功地优化一个拆分催化醇醛与isobutyraldehyde耦合(图3)。一个手性膦提供enantiocontrol,主要是syn -醇醛加合物在一篇出色的87%的收益率,99%的对映体过量。
探索各种脂肪族醛耦合伙伴通常提供优秀的收益率和构型,只要少量的(8摩尔%)2-methylthioethanol添加需要维持高在哪里syn:反选择性。
令人惊讶的是,当团队芳香醛,选择性很大开关来支持反醇醛加合物,选择性擦除,实现本质上外消旋的产品。引入一个更大的部分(30 mol %) 2-methylthioethanol恢复一些选择性,与机械的研究表明添加剂能抑制和并发racemisation retro-aldol反应,可能通过竞争结合金属催化剂的反应产物。
这个反应出现的范围很有限,尤其是选择性下降时远离核心基板。也就是说,醇醛受体相对较少出现在报纸上,目前还不清楚团队探讨了多远。此外,报告只有两个膦配体变异,表明反应可能进一步调优。
虽然indolyl酰胺结构本身并不容易修改,它的行为类似于综合有用发现酰胺。它可以转化为酮使用有机金属的亲核试剂,或直接降低醛或酒精。硫醚组提供了一个处理进一步derivatisation,减少和团队演示一个激进的和激进的烯丙基化作用与一个有趣的保留收益配置。
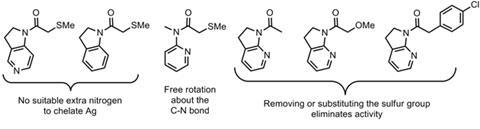
应用该系统在复杂分子合成可能不是特别普遍。然而,使用外部添加剂的想法调节酰胺的反应通过限制其构象更加有趣。虽然这个假设很难直接证据证明,这一事实几个相关的醇醛捐助者都没有反应在同等条件下(图4)表明,这绝对是合理的。外部诱导的前提构象不起化学反应的碳氢键的活化是应该考虑更广泛。
卡尔·柯林斯(@karlDcollins)是一个明斯特大学的研究员,德国,和博客retrosynthetic生活








还没有评论