第一阶段临床试验已经开始,该候选疫苗可以对抗多种流感病毒
谈谈最好的时代和最坏的时代。疫苗的丰年仅仅因为缺乏疫苗而造成的破坏,以及疫苗生产和分发仍然需要进行的紧迫性而黯然失色。当然,我说的是针对Sars-CoV-2的疫苗(诺贝尔奖有争议地忽视了它,部分原因是人们认为可能被放弃的技术细节)。但现在也有了对抗疟疾的疫苗,目前撒哈拉以南非洲每年约有40万人死于疟疾。Covid-19大流行在破坏疟疾预防和治疗方面的间接影响可能比病毒本身造成的死亡人数更多。因此,开始使用葛兰素史克公司(GlaxoSmithKline)开发的RTS,S/AS01疫苗来保护儿童免受疟疾侵害的决定令人深感鼓舞。
但在所有的兴奋中,疫苗领域另一项潜在的变革性发展被某种程度上忽视了。对控制Sars-CoV-2传播的努力持放任主义态度的反对意见之一是,我们每年通常会接受数千人死于流感,所以为什么要对另外数千人如此担心呢?但伦敦卫生和热带医学学院的马丁·麦基向我建议,这是一种错误的看待流感的方式:我们不应该接受这么多流感死亡,事实上我们也尽量不接受。
流感疫苗已经起到了很大的作用——美国疾病控制和预防中心估计,在好的年份,它们可以减少40-60%的严重疾病——但没有我们想要的那么大。部分原因是疫苗必须针对特定的流感变种而量身定制,但流感变种有很多,我们无法提前确定哪一种会在特定的流感季节占主导地位。理想的解决方案是一种通用的流感疫苗,可以保护所有人。
这是一个艰难的目标.1在流感变异如此多样的情况下,这种疫苗能提供什么信息来刺激免疫反应?两种主要的人类流感病毒,甲型流感和乙型流感,都有一种被称为血凝素(HA)的糖蛋白点缀的病毒外壳,这种糖蛋白与宿主细胞结合。这种蛋白质在不同的变体中具有不同的结构,第二种被称为神经氨酸酶的关键蛋白质也是如此。(这两个分子就是H1N1病毒标签中的H和N。)对疫苗的免疫反应主要是由暴露的HA蛋白引起的。
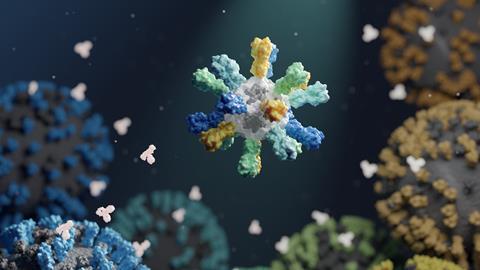
位于马里兰州的美国国立卫生研究院的巴尼·格雷厄姆和他的同事,以及华盛顿大学的同事,发现解决多样性问题的一个可能的办法是设计疫苗它包含附着在单个颗粒上的几种常见HA类型的外膜域(蛋白质中不包括膜锚的部分)。2为了将这些蛋白质组合在一起,他们巧妙地制造了一些自我组装。他们使用基因工程从四种现有的流感疫苗(两种针对甲型流感,两种针对乙型流感)中生产出HA外结构域,这些疫苗被附着在一个蛋白质支架上,该支架经过计算设计,可与另一种蛋白质组装成具有二十面体对称的纳米级结构。然后将所有成分混合在一起,产生自组装的蛋白质核心,其中有四种HAs的混合物:总共20种(每种类型5种),以重复的模式。如此高的多价粒子应该会向免疫系统发出强烈的信号。
在老鼠、雪貂和猴子身上进行的试验表明,这些“镶嵌”纳米颗粒可以对一系列流感病毒产生良好的免疫反应。特别有希望的是,实验疫苗还刺激了针对HA蛋白茎区(连接暴露的头部和病毒外壳的部分)的宿主抗体。与头部区域相比,该区域在不同菌株之间的差异要小得多,因此引发“茎反应”的疫苗可能比仅由头部决定的范围更广。的确,格雷厄姆的团队做到了之前的研究只使用茎结构域的宽效纳米颗粒疫苗。3.
今年5月,美国国家卫生研究院开始了名为FluMos-v1的新候选疫苗的一期临床试验。第一步评估安全性,在一小群志愿者中寻找不良反应。在我们知道它是否能提供全面的流感保护之前,还有很多工作要做。
尽管如此,基础工作还是很快就完成了,因为当该团队的论文于去年5月提交时,Graham和许多其他先前从事广谱流感疫苗研究的研究人员,包括牛津大学的Sarah Gilbert,都在忙于更迫切的疫苗需求。现在,这项工作也考虑到了一个类似的挑战:开发一种可能对抗过去和未来所有潜在变体的新冠病毒疫苗。其他公司,如与葛兰素史克(GlaxoSmithKline)合作的总部位于加州的Vir Biotechnologies,也在走同样的道路。让我们希望疫苗的慷慨还能提供更多。
参考文献
爱森斯坦,自然, 2019,573, s50 (doi:10.1038 / d41586 - 019 - 02751 - w)
S博奥卢-巴纳姆等,自然, 2021,592, 623 (doi:10.1038 / s41586 - 021 - 03365 - x)
3 H M Yassine等,Nat。地中海。, 2015,21, 1065 (doi:10.1038 / nm.3927)










暂无评论