全合成有时是探索天然产物周围化学空间的唯一方法
人们常常觉得,化学家在全合成论文开头谈到的生物活性只是一种模版。但天然产物仍然是新药的重要来源。在抗生素和肿瘤学等治疗领域,天然产物及其衍生物占已批准药物的一半以上。1这些年来,大型制药公司对天然产物化学的热情时起时伏,但随着后抗生素时代的幽灵逼近,化学家们再次从自然界中寻找对抗耐药细菌的灵感。
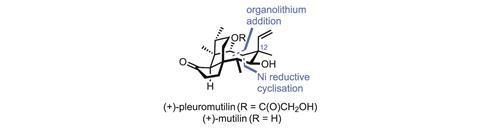
二萜真菌代谢产物(+)-胸膜残素已经成功地作为抗生素开发的起点。从天然胸膜残素开始,葛兰素史克(GSK)创造了retapamulin这是一种强力抗生素,于2007年获得美国食品和药物管理局(FDA)批准。LefamulinNabriva Therapeutics公司的另一种胸膜多肽衍生化合物也在临床试验中。然而,尽管这种半合成方法通过将工作从化学家转移到发酵罐来节省时间和金钱,但它们确实有缺点。一个主要的限制是,团队经常受困于大多数自然产品结构,因为做大的改变太难了。事实上,GSK和Nabriva团队都选择简单地交换分子的外周酰基侧链,留下了大量的化学空间——以及许多潜在的新药——未被开发。这是不幸的,因为对分子的八元环的调整,例如反转C-12立体中心,可以深刻地改变它的生物活性。然而,对收获的天然产品进行这些改变通常是费力的——在根本可能的情况下。
尽管全合成的有用性一直存在争议,但人们普遍认为,探索全合成的重要性是必要的结构与活性关系一种具有生物活性的天然产品可能是它仍然不可或缺的少数领域之一。但是,尽管已经实现了几次令人印象深刻的全合成胸膜残素,但在设计合成路线时并没有考虑到这一目标。美国耶鲁大学的Seth Herzon和他的同事采用了一种模块化的方法,现在已经为详细研究从天然产物本身无法获得的新类似物奠定了基础。2
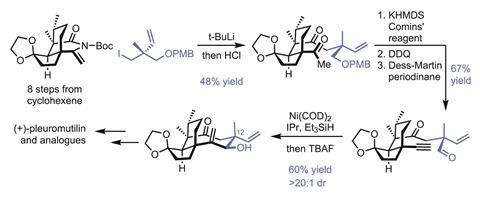
该小组首先快速组装目标的五元环和六元环,仅需要8步就可以从环己酮制备对映纯环烯亚胺,总收率为20%。接下来是安装环辛烷环剩余一半的关键片段耦合(图2)。最后添加这个单元(具有改变其组成的灵活性)确实是这种方法的天才之处,毫无疑问,该团队将在未来利用这种模块化进一步探索相关的化学空间。
将剩余的碳原子钉在烯亚酰亚胺上,首先将有机锂添加到烯亚酰亚胺上。虽然48%的产率一开始看起来不大,但值得注意的是亲核试剂和亲电试剂都是新戊二将两个这样的第四系中心结合在一起是很困难的。接下来,甲基酮转化为炔,然后p-甲氧基苯基保护的醇暴露并氧化。一个挂式镍催化下的选择性还原循环完成了最后的环。这里的区域选择性和非对映选择性是相当令人印象深刻的,如果这种方法可以做出一个八元环,它可能也适用于其他尺寸的环,只要挂式-选择性有效。碳骨架现在已经完成了,只需要稍加氧化水平的调整和C-12中心的倒置就可以完成自然产物。
通常为了获得这种程度的灵活性,化学家们被迫牺牲效率,虽然这不是一种制造路线,但我认为这种合成在平衡两者方面做得很好。该小组现在正准备制造合成胸膜素的文库,我很期待他们的发现!
参考文献
D·J·纽曼和G·M·克雷格,纳特。, 2016,79, 629 (doi:10.1021 / acs.jnatprod.5b01055)
2 S K Murphy,曾M, S B Herzon,科学, 2017,356, 956 (doi:10.1126 / science.aan0003)










暂无评论