用非传统的化学方法来改变
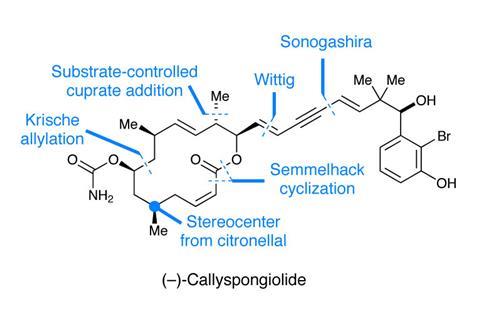
我不太喜欢大环内酯类全合成。虽然不可否认,这背后有很多技巧,但我有时发现很难欣赏艺术,因为我从未制作过大环内酯,也没有深入研究过这个领域。在我未经训练的眼睛看来,这些合成通常包括一系列已经确定的反应——通常是烯丙化和烯丙醇——逐步形成一个不可避免的酯型大内酯化,这看起来往往是虎头蛇尾。有着巨人般的肩膀大卫埃文斯而且伊恩•帕特森在一个可靠的反应和成功蓝图已经存在的领域,创新的动力可能很少。所以当我看到帕特里克·哈兰用“非常规”这个词来描述他的(−)-callyspongiolide(图1)的路线,我很感兴趣。1如果有人能抛开这些比喻,找到一个有趣的方法来做一个大环,那就是Harran,他的witkop式方法来做重氮酰胺a的第二个大环,是我能想到的联芳键中最不明显的断开之一。2
第一个令人惊讶的地方是没有二酸中间体:一端是醇,另一端是酸的底物,其类似衔尾蛇的包裹通常是大环内酯合成的结局。Harran还免去了通常的醛醇化学反应,虽然该路线确实有烯丙化反应,但它肯定不是传统的。这种创造性也不仅仅是为了作秀——在已经公布的三种通往这种分子的路径中,哈兰的路径是最短的。
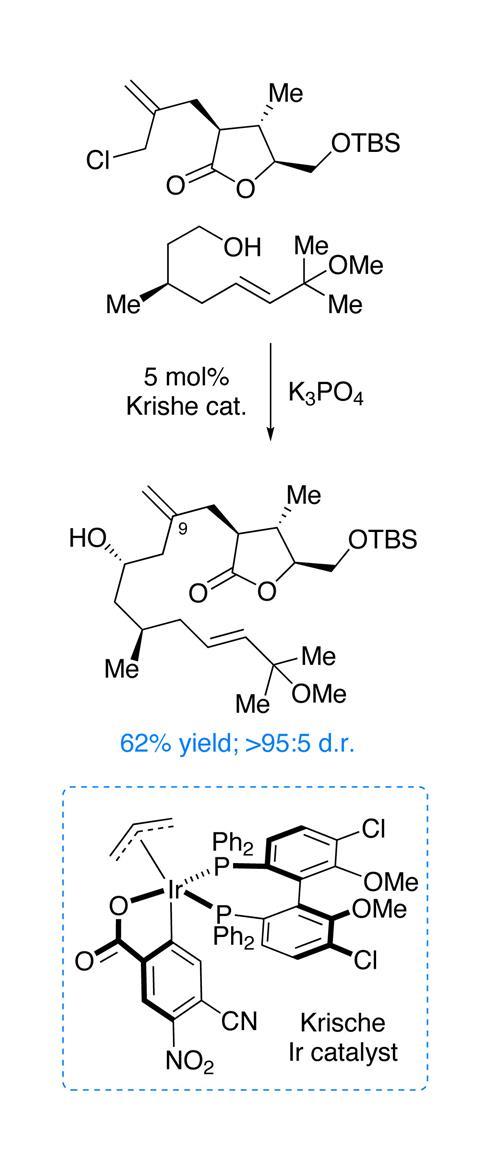
在手性池中,两个关键的组成部分由纤维素(内酯)和香茅醛(酒精)组装而成。然后使用Krische的手性铱催化剂有效地耦合,以产生最不寻常的烯丙化。这个反应不同寻常有几个原因:这里的“亲电试剂”是被氧化的酒精原位通过神奇的氢转移。烯丙基氯是高度功能化的,不使用化学计量有机金属试剂。铱催化激活卤化物(通过氧化插入)和醇(通过氧化),然后将两者以近乎完美的非对映选择性结合,使氯化氢成为唯一的副产物(图2)!虽然成品率只有62%,但从两个片段一对一的混合(这很关键,因为两者都需要多步合成)中获得它是一个令人印象深刻的成就。
经过几次简单的操作后,该小组将目光放在了关键的大环形成步骤上,这在目前的二恶过氢蓝烯中间体中是很难想象的(事实上,七元环的形成只是为了让C-9烯烃的加氢以所需的立体选择性进行)。首先,用过氧化氢在酸催化下形成半iketal。然后将中间的过氧化物与硫酸铁和醋酸铜分解,得到同烯丙基乙酸酯,并将其与碱剪切,得到同烯丙基醇。semmelhack类型的钯介导的羰基环化级联形成了大内酯,但将剩余的仲醇连接到一个不需要的吡喃环上。幸运的是,二异丙酰胺锂引起的碎片破坏了吡喃,轻松地在环中安装了所需的不饱和,尽管不正确E几何。然而,第三幕扭转——光平衡——后来纠正了这个问题(图3)。
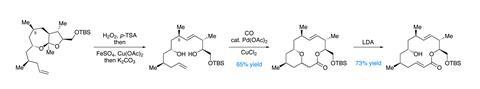
我印象深刻的是,这个团队的独特方法是如何巧妙地将仲醇纳入到环化步骤中,从而避免了保护基团的化学反应,否则,如果它只是站在一边,就可能需要保护基团。从这里开始,氨基甲酸酯和炔基依次加入,整个过程只需要18个线性步骤就完成了。
祝贺该小组在大循环合成方面具有高度创造性的方法。
参考文献
1.P G哈兰等,j。化学。Soc。, 2018, doi:10.1021 / jacs.7b13591
2.P G哈兰等,Angew。化学。, Int。艾德。, 2001, 40,4765 (doi:10.1002 / 1521 - 3773 (20011217) 40:24 < 4765:: AID-ANIE4765 > 3.0.CO; 2)










暂无评论