美国化学家已经开发出一种方法,可以简化目前极其困难的为特定工作定制设计蛋白质的过程。尼克Polizzi而且比尔DeGrado来自加州大学旧金山分校(UCSF)的研究人员使用蛋白质数据库(PDB)中的数千种蛋白质结构来定义一个新的结构单位。他们不再担心蛋白质中每个氨基酸残基侧链的确切位置,而是将注意力转移到每个残基所接触的化学基团上。利用他们的方法,他们从头设计了两种不同的蛋白质,可以识别血液稀释剂阿哌沙班。
到目前为止,最好的蛋白质设计算法需要许多后续实验来优化蛋白质序列,以结合像药物一样的化合物。相比之下,UCSF团队通过计算设计并制作了六个序列来找到他们成功的两个设计。“现在有可能从头开始设计结合复杂小分子的蛋白质,”降解说manbetx手机客户端3.0.“我们希望其他人能和我们一起使用并改进这种方法。”
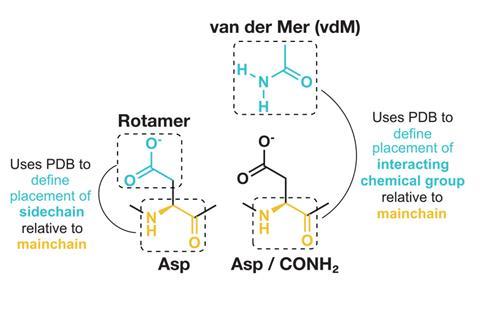
Polizzi和DeGrado的方法使用了一种叫做范德默蛋白(vdM)的蛋白质结构单元。这个名字结合了两个结构思想。一种是范德华引力,它可以将紧密接触的分子聚集在一起。也指氨基酸采用的不同侧链构象的转链体。vdM将每个氨基酸的主干映射到PDB中发现的附近相互作用的化学基团。“直到现在,PDB才足够大,我们才能为每种残留类型和二级结构定义vdm。”“这听起来可能与早期的方法非常相似,但这项工作的成功需要我们的参照系进行微妙的转变。”
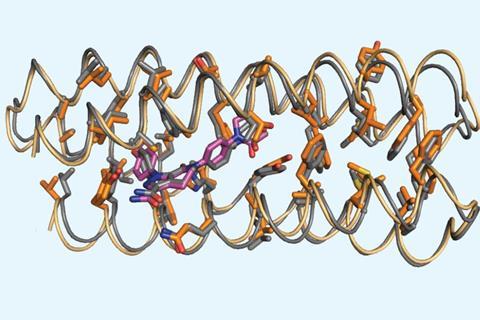
一位加州大学旧金山分校的心脏病专家建议将阿哌沙班作为一个具有挑战性的结合靶点,因为成功可以快速逆转其在手术中可能需要的血液稀释作用。两种不同的蛋白质束,其中一种具有较长的链和不同的序列,都将阿哌沙班与低微摩尔范围内的解离常数结合。
罗伯特•奇卡加拿大渥太华大学的研究人员称,这一结果“非常令人兴奋”,“处于计算蛋白质设计领域的前沿”。他说:“重要的是,这个结果是在不需要对所设计的蛋白质进行下游工程来增强它们的稳定性或配体结合活性的情况下实现的,这与以前其他小组从头设计配体结合蛋白的例子形成了对比。”
Polizzi指出,这种设计方法可以为小分子药物生产基于蛋白质的递送载体和逆转剂。他补充说:“我们也在扩展方法,思考如何设计骨架和结合位点。”
参考文献
N F Polizzi和W F降解,科学, 2020, doi:10.1126 / science.abb8330









暂无评论