酶迅速变化之间至少有四个不同的3 d形状催化化学反应,研究人员发现。观察这个酶的蜕变是通过捕获单个分子纳米孔内电场。这种方法可以帮助了解酶的工作,这可能帮助创造更强大的,甚至工程人工酶。
后第一个酶晶体结构解决了在1960年代,科学家们意识到酶折叠成一个三维的形状,形成一个活跃的站点为基质融入和催化反应. .然而,越来越多的证据表明,一些酶转变之间的多个极化子形状,或矫形器,在一个反应。
理解这些变化及其层次结构可以帮助优化酶应用程序的性能。这需要研究在单分子水平但现有方法来实现这一目标,包括荧光标签,是有限的,往往因为酶的构象变化太小被检测出来。
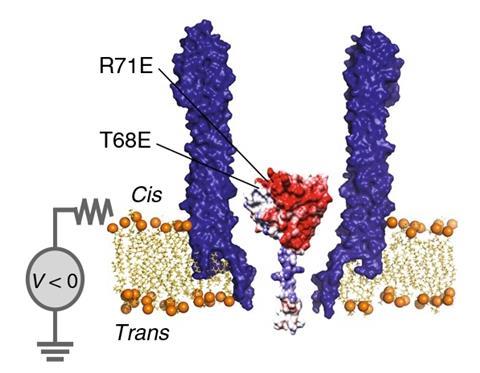
现在,乔凡尼Maglia格罗宁根大学的研究小组,荷兰,克服了通过将单个球状酶,二氢叶酸还原酶(DHFR),在纳米孔。测量离子电流的调节孔表明酶折叠成四个不同的3 d结构。
矫形器的显示基板和产品的亲和性不同,和他们交换交叉反应过渡态时,“Maglia解释道。我们建议这种机制来增加产品发布的效率很重要,这是对限制一步催化反应速率。这个观察表明因此酶反应是更复杂的比之前预计的要高。”
纳米孔很微小开口跨越一个绝缘膜——在这种情况下,纳米孔是蛋白质和细胞膜脂质双分子层。虽然离子电流通过纳米孔已经使用了十多年研究配体结合蛋白在单分子层,这是第一次观察到单个步骤的酶促反应在一个孔。
研究人员设计DHFR -经常研究模型酶与赖氨酸标签陷阱里面修改溶细胞素电场下的孔隙。负电位时,DHFR进入纳米孔和标签粘在孔隙的带负电荷的内部。
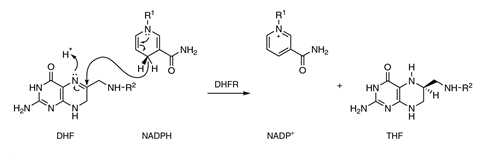
膜上的电势生成一个离子电流穿过孔。当叶酸和辅助因子烟酰胺腺嘌呤二核苷酸磷酸(NADPH)补充说,他们的绑定DHFR改变离子的流动,揭示不同酶的构象,同时减少tetrahydrofolate衬底。
我们没有预料到观察多种酶的构象,“Maglia说。我们也惊奇地发现,离子电流通过纳米孔是如此敏感的微小差异蛋白质的结构。
虽然方法本身是一个令人印象深刻的实验成绩,最引人注目的发现是衬底绑定和营业额的建议可以在酶低能量构象交换障碍,“超分子化学说斯科特Cockroft英国爱丁堡大学的。理解再造的原则这样的动力可能是利用已知的酶,甚至发展人工酶。”
引用
Biesemans和G Maglia N S Galenkamp,Nat,化学。,2020,DOI:10.1038 / s41557 - 020 - 0437 - 0







还没有评论