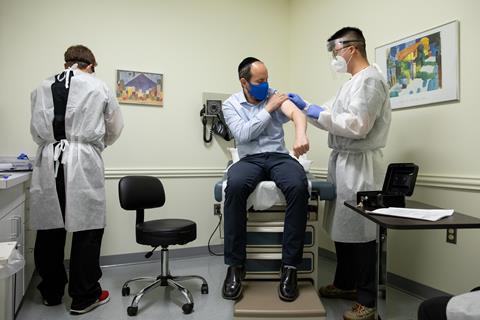
辉瑞- biontech达到紧急授权的安全阈值,而Moderna的数据显示95%的有效性
试验数据的初步分析表明,Moderna的mRNA Covid-19候选疫苗可能提供约95%的预防疾病的保护。这与辉瑞和BioNTech的mRNA疫苗类似,后者目前已达到所需的安全监测阈值和病例数,可以结束试验并在美国申请紧急使用授权。
现代化索赔根据该公司在美国进行的3万多名参与者中的95例Covid-19病例,疗效为94.5%。其中,90人在安慰剂组,5人在疫苗组。11名志愿者出现了严重的症状,但他们都没有接种疫苗。
辉瑞生物科技的最新数据根据170例(安慰剂组162例,疫苗组8例),给予95%的疗效。重症病例10例,其中1例为接种组。两家公司还表示,他们已经超过了美国食品和药物管理局的安全监测阈值,这意味着他们现在将在美国申请紧急使用授权。
如果一家公司能够为单剂量疫苗提供相当有前景的数据,那么我认为其他三种疫苗将很难与他们竞争
疫苗的科学家格雷戈里·波兰美国罗彻斯特梅奥诊所的博士称Moderna的释放是“非常鼓舞人心的消息”,尽管与Pfizer-BioNTech但是,这一早期发布的信息不能包括疫苗的长期持久性或是否能防止无症状传播的信息。
Moderna疫苗可以在-20°C左右的标准冷冻温度下储存30天,这使得它比辉瑞生物科技的疫苗更容易处理。波兰补充说:“如果这种药物的有效性和安全性得到证实,它将改变游戏规则。”
Moderna的疫苗需要初始剂量和加强剂,从第二次剂量后14天开始测量保护。据观察,这意味着大约需要42天才能充分发挥保护作用邓炎昌缰绳他是加拿大圭尔夫大学的病毒免疫学家。同样,辉瑞-生物科技公司测量了加强剂量后7天或初始剂量后28天的保护水平。
俄罗斯人造卫星5号疫苗的中期结果已经公布也已发布,说明疫苗的有效性为92%。这是基于小得多的数字:在1.6万人接受两剂腺病毒载体疫苗的试验中,有20例Covid-19确诊病例。有人提出了担忧当时这种疫苗仅在俄罗斯进行了一个小的一期研究后就被批准了。
专家们相信,牛津大学-阿斯利康团队也将很快报告其黑猩猩腺病毒载体疫苗的结果,其他几个疫苗的试验进展顺利。Bridle特别兴奋的是,其中一些候选药物正在进行单剂量测试,可以在大约14天后提供保护。他说,如果他们能拿出相当有希望的数据,那么我认为其他三种疫苗将很难与他们竞争。Poland观察到腺病毒载体疫苗通常有不舒服的副作用——可能比mRNA疫苗更严重——这可能不利于它们。也就是说,所有可用的疫苗可能需要同时部署,以满足世界各地的初始需求。
虽然这些公司自然希望分享他们的初步结果——既为了透明度,也为了鼓励预订交易,免疫学家现在正在等待同行评议的论文。布瑞德说:“这些媒体发布的消息非常令人沮丧。“在完全缺乏相关数据的情况下,没有科学家能确切地说出这些疫苗会有多好。”
编者注:本文在11月18日发表后进行了编辑,以澄清有关牛津-阿斯利康疫苗和其他正在开发的候选疫苗的信息








暂无评论