极不寻常的结构有一个内部充满了五角冰网络暂停冰晶的形成

一个名为马克西的抗冻蛋白有助于预防冬季比目鱼北大西洋冻结在冰冷的海水中。但是一个新的研究表明,马克西有着惊人的结构,因为它的工作。它是充满冰。
彼得•戴维斯加拿大女王大学和他的同事们推断马克西的晶体结构,发现它已经在其核心超过400水分子连接到一个像冰一样的网络。这使得一个非常不寻常的分子,不仅是因为蛋白质与紧凑,球状折叠态通常有一个研发或疏水几乎完全干燥室内,但也因为大量的被困水马克西是如此高度周围组织的蛋白质支架。
“我们不知道任何先例内水的规模,”戴维斯说。格哈德悍马德国马克斯普朗克研究所的生物物理学的赞同。这是我所见过的最神奇的蛋白质结构之一,”他说。“起初,我发现很难想象,这样的结构有限的直接交互(肽链之间)将是稳定的。
生活在冰箱里
抗冻蛋白抑制有害的冰晶的形成在鱼类生活在接近冰点的水。他们中的许多人绑定到冰晶的表面逮捕他们的成长。理解的分子机制不仅会提高我们的知识的生命得以延续的冻结条件,但可以应用于低温贮藏。发现马克西的解决方案,戴维斯和他的同事们对蛋白质进行了x射线晶体学在美国布鲁克海文国家实验室。
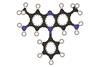
马克西有145长棒状的形状,由两个螺旋线圈对折发夹和并排四螺旋产生一束。在中央部分的包有两个空挡通道螺旋之间的相交成直角,每个宽足够容纳一个层的水分子。内部衬里的渠道大多是由疏水氨基酸,特别是丙氨酸。
研究人员发现,这种内部区域充满了水分子氢键的网络主要是五元环。在普通冰水分子形成六元环;五角网络特征与其晶体称为包合物,水小分子溶质周围结冰。
马克西的包合物网络弯曲inward-pointing side-groups蛋白质螺旋。戴维斯和他的同事们认为,室内水溶剂的残留的蛋白质折叠——水通常被完全从生物体的蛋白质在温暖的气候。
五边形的保护
“哈罗德Scheraga 50年前预测,水分子之间非极性残留物会形成包合物五角戒指,“生物物理学家说杰里米•史密斯美国橡树岭国家实验室的。“五角水构建疏水蛋白质表面已经观察到以前,但我没有见过这样的一个广泛的阵列。”
水之间的网络延伸出四个螺旋段,可以合并与氢键网络的冰晶体,使蛋白质附着在他们和停止增长。换句话说,而许多抗冻蛋白表面一层水分子的组织,这样他们就可以绑定到冰面,这里绑定似乎由包合物介导而不是线圈之间的泄漏。
被困水床单会因此为冰绑定提供分子尼龙搭扣,“悍马解释道。虽然他认为解释“可能的”,他说,提出问题。”例如,为什么这样一个蛋白质不泡核的形成冰吗?为什么蛋白质不会纳入越来越冰,自各方ice-interacting负债表伸出吗?”
问题仍对马克西的结构体内。“我担心都是水晶做的,”史密斯说。“水晶接触有可能构建影响水吗?我们需要一些证明下令内部溶剂在溶液中仍然存在。
其他蛋白也可能有类似的“冰胶”?如果一个购买功能假说,人们会认为其他蛋白质应该利用这种结构为通用绑定到极表面,”说,悍马。但有可能马克西的一些特点来自其专业功能,戴维斯说。“这些蛋白质折叠和工作在零甚至零下的温度,“他说。这样的蛋白质往往更多地依赖于氢和二硫键的连锁在一起,而不是疏水包装的核心。马克西保持水的条件,存在如此规模的内部相当特别,”他补充道。






还没有评论