获奖基因编辑工具背后的科学可能会改变我们的生活
Emmanuelle贝纳而且詹妮弗Doudna已经把2020年诺贝尔化学奖“开发了一种基因组编辑方法”。具体来说,他们因发现Crispr-Cas9基因组编辑技术而获奖,该技术使科学家能够精确改变生物体的遗传密码。Crispr-Cas9是一种强大的工具,可以彻底改变我们生活的许多方面,从医疗到我们生产食物的方式。近年来,它也引发了不少争议。在这里,我们将深入了解这些“基因剪刀”,以及它们获得诺贝尔奖的原因。
它为什么会赢?
自2011年Charpentier和Doudna开始研究Crispr-Cas9系统以来,这一领域出现了爆炸式增长。由于Crispr系统的相对简单性和可负担性,世界各地的研究人员已经能够将这些工具应用于各种不同的问题。今天,有专门的期刊、会议和公司致力于这项技术。
在选定位置切割任何DNA分子的能力具有巨大的潜力——从治疗遗传疾病到培育抗病作物。试验甚至显示了crispr传递的基因修饰如何在蚊子种群中传播并阻止疟疾感染——这种“基因驱动”提供了一种完全消除疟疾的方法。面对Covid-19大流行,研究人员已经找到了在冠状病毒快速诊断测试中使用Crispr的方法,并提出用它来攻击病毒的基因组。
正如诺贝尔化学奖委员会主席克拉斯·古斯塔夫松(Claes Gustafsson)在颁奖典礼上所说,这种基因工具具有巨大的力量,它影响着我们所有人。
Crispr技术甚至被用于制造更美味的啤酒.
它是如何工作的?
整个Crispr基因编辑工具是从细菌的免疫系统改编而来的。Crispr一词来源于“整齐排列的短回文重复序列”,指的是在细菌基因组中发现的不同基因序列。每个Crispr序列都被转录成RNA序列,这些RNA序列将靶向病毒的DNA。这些序列还包括中科院(crispr相关)编码dna切割Cas酶的基因。引导RNA和Cas酶一起形成一个复合物,寻找病毒DNA并将其切碎。
在Crispr基因编辑中,科学家们通过设计一个大约20个碱基的引导RNA序列来重新利用这个系统,该序列与他们希望在细胞基因组中靶向的DNA序列相匹配。该RNA序列与Cas9酶配对,Cas9酶将在目标位点切割DNA链。编码Crispr-Cas9工具这两种成分的整个DNA序列可以通过质粒传递到靶细胞。
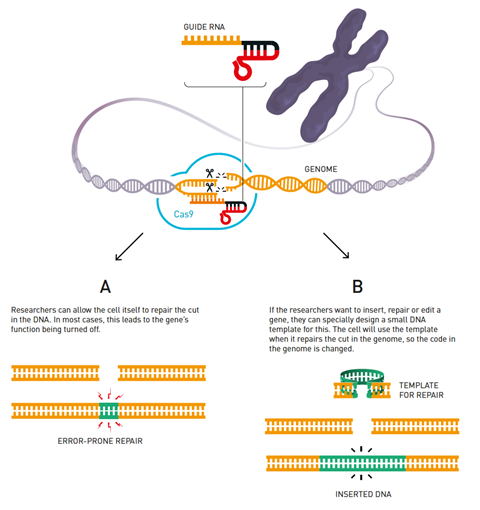
因此,该工具可以被用于以难以置信的精度编辑细胞基因组——例如,它可以切除与遗传性疾病相关的功能失调基因。如果健康版本的基因也被传递到细胞中,细胞自身的修复系统就会在被切割的地方整合健康的基因链。
获奖者都做了什么?
2011年,在调查细菌时酿脓链球菌, Charpentier发现了一种叫做tracrRNA的分子,它是细菌Crispr-Cas系统的关键组成部分。
与此同时,杜德纳一直在研究中科院基因,并了解到它们编码的Cas蛋白质参与切割DNA,作为细菌免疫系统对抗致病病毒的一部分。

那一年,夏彭迪埃与杜德纳合作,进一步研究了这个系统。他们一起揭示了Cas9蛋白、CrisprRNA和tracrRNA如何共同工作,将DNA链剪成两部分。然后,他们将CrisprRNA和tracrRNA结合成一个单一分子-引导RNA -简化了系统,使其更容易使用,并展示了如何使用它在他们选择的位置切割任何DNA链,为在各种基因组编辑实验中使用该工具打开了大门。
虽然之前的基因编辑工具在Crispr-Cas9之前就已经存在,但新工具更简单、更便宜。这使得全球各地的科学家都可以使用基因编辑,从而导致了该领域的巨大扩张。
那么争议在哪里呢?
多年来,Crispr一直处于一个长期的专利纠纷.在Doudna和Charpentier的发现后不久,张锋(Feng Zhang)的团队在美国剑桥布罗德研究所(Broad Institute)申请了一项在真核细胞中使用该技术的方法的专利。杜德纳在美国加州大学伯克利分校的团队和布罗德团队之间就谁拥有关键的知识产权进行了长期的法庭斗争。与此同时,许多集团和公司已经获得了许多与crispr相关的新技术的专利,这意味着随着时间的推移,处于争议中心的原始专利将被剥夺变得不那么重要.
另一个有争议的领域是使用基因组编辑工具的潜在后果。由于基因组是如此复杂,当我们编辑基因时,我们并不总是知道会发生什么。一些基因具有多种且通常未知的功能——编辑它们以纠正一个问题可能最终会产生新的不可预见的问题。当涉及到编辑生殖细胞(那些可以传递给生物后代的细胞)时,这一点尤其重要,因为修改后的基因可以被后代遗传。
作为一项相对较新的技术,我们也知道Crispr本身并不完美。一些研究显示了脱靶切割,即该工具在额外的位置将DNA链剪切到所需的位置。这显然会产生有害的后果,因此许多研究人员正在寻找改进技术的方法,使其更适合于医疗用途。
考虑到这些问题,世界各地的科学家——包括Doudna和Charpentier——已经开始关注呼吁暂停编辑人类生殖细胞,直到我们知道更多的后果。这样的呼吁愈演愈烈此前,流氓中国科学家贺建奎编辑了2018年足月出生的人类胚胎。他现在是服刑三年进行这项研究。
接下来会发生什么?
基于crispr疗法的几项临床试验已经开始,今年将出现有前景的报告。今年2月,首个研究使用crispr编辑免疫细胞治疗癌症的研究报告称改良细胞是安全的三名患者均未出现严重副作用。虽然这种治疗对癌症的疗效很小,但它可能有助于为未来基于crispr的t细胞治疗提供信息。
一个月后,一名遗传性失明患者成为有史以来第一个接受Crispr-Cas9治疗的人直接注射到他们体内.今年6月,瑞士基因编辑公司Crispr Therapeutics宣布两名贝塔地中海贫血患者和一名镰状细胞病患者在使用Crispr技术编辑骨髓干细胞后,将不再需要输血。
本周早些时候,杜德纳成立了一家新公司Scribe Therapeutics,开始研究肌萎缩性侧索硬化症的治疗方法。
其他基于crispr的技术也在不断涌现更接近商业现实.例如,美国基因组工程公司eGenesis正在开发利用该技术编辑猪基因的方法,以便将它们的器官安全地移植到人类身上。在农业领域,许多公司正在研究如何使用Crispr来加快作物的选择过程,以获得抗病或改善风味等理想特性。
在基本层面上,研究人员正在研究改进系统本身的方法。通过使用替代Cas蛋白,一些研究小组希望使该工具在某些情况下更有效、更容易使用。杜德纳的团队最近报道CasX蛋白比Cas9小,可能更容易引入靶细胞。
额外的信息
将DNA传递到细胞和组织中是基因治疗的重要组成部分,对于Crispr-Cas9方法更是如此,因为携带这种系统的质粒非常大。这篇研究论文描述了一种非病毒载体,用于将携带Crispr-Cas9的质粒DNA递送到肿瘤球体中,这是很好的体外组织模型,但也具有挑战性的转染靶标。
1 S J Zamolo, T Darbre, J- l remond,利用CRISPR/Cas9质粒DNA转染组织模型,化学。Commun。, 2020, doi:10.1039 / d0cc04750c
调控Crispr-Cas9的功能已提上许多研究人员的议事日程,因为以空间和时间方式限制它的能力为精确操纵基因组和最小化任何副作用打开了大门。通过在系统中引入可光性基团,这些研究人员展示了他们如何利用光调节Cas9的活性
2王勇等引导RNA位点特异性化学修饰对CRISPR/Cas9功能的光控化学。科学。, 2020, doi:10.1039 / d0sc04343e
Crispr-Cas系统似乎不仅仅适用于基因编辑。本文描述了如何使用Crispr-Cas系统来组装包含五种不同酶的多酶级联。这项工作背后的团队希望它可以成为构建复杂的支架生物催化途径的通用方法的开端
3林S等CRISPR/ cas定向可编程组装多酶复合物,化学。Commun。, 2020,56, 4950 (doi:10.1039 / d0cc01174f)
最后,这里有一些关于Crispr-Cas9的工作原理,治疗性纳米颗粒的递送过程以及这些过程的生理障碍的综述
4徐勇,刘荣荣,戴震,基于CRISPR/ cas9纳米颗粒的治疗性基因组编辑,纳米级, 2020, doi:10.1039 / d0nr05452f
5龚Y等脂质和聚合物介导的CRISPR/Cas9基因编辑,j .板牙。化学。B, 2020,8, 4369 (doi:10.1039 / d0tb00207k)










暂无评论