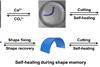
自组装蛋白管可以形成一个灵活的分支网络,可以支持生长的细胞
一个国际研究小组做出了以蛋白质为基础的管状结构,可以通过手动从现有的管中抽出新的分支来形成网络.该结构具有自愈性和生物活性,可以支持人体细胞的生长,用于组织工程。
阿尔瓦罗·马塔伦敦玛丽女王大学的教授和以色列、葡萄牙和西班牙的合作者将分子自组装与直接物理操作相结合,从蛋白质膜中抽出了这些管。它的基本结构是一种合成多肽的复合物,这种合成多肽基于弹性蛋白——一种在结缔组织中发现的有弹性的蛋白质——和一个小的两亲性多肽,其头部是水溶性的,尾部是脂肪质的,不溶于水。这种肽两亲体(PAs)之前已被证明能够在水中自组装成纳米纤维和凝胶等结构,这些结构本身已被探索为细胞生长的潜在支架。
当Mata和同事们将PA溶液添加到类弹性蛋白(ELP)中时,PA形成了一个大致球形的团,包裹在软膜中,该软膜由ELP-PA复合物组成。在它们自己的作用下,弹性蛋白分子在水中会坍缩成一团。但是当PAs通过氢键和静电相互作用等非共价相互作用与它们结合时,它们可以以类似于蛋白质变性的方式打开,因为PAs可溶解多肽的疏水部分。ELP-PA复合物可能聚集形成膜。电子显微镜显示,这是一个多层结构,就像千层面一样,每一层只有几纳米厚。
如果用玻璃棒、手指或其他什么东西触摸薄膜,它会在几分钟内改变形状,在被触摸的地方形成一个开口。如果它的顶部和底部被触摸,它会打开一个管子,最终连接到溶液的顶部和底部,里面仍然有PA溶液。同样地,如果一根玻璃棒接触到管壁,就会形成一根新管,可以像树枝一样轻轻拉出来。挤压过程看起来很像尼龙线从两种聚合液体的界面被拉出来。
玛塔说,任何接触都会打开薄膜。“如果我们将肽滴注射到ELP的游泳池中,然后用你的五个手指触摸它,你会在水滴周围打开五个开口,每个开口都有你指尖的直径。研究人员已经挤出了窄至800微米的管子,但Mata说他有信心可以做得更窄。当试管被挤压时,它可以迅速自愈膜上的任何破裂。
可成形的支架
考虑到弹性蛋白的生物相容性,Mata和同事们认为他们的管状支架可能是生长活细胞的良好宿主。他们发现,来自脐部组织的小鼠干细胞和人类内皮细胞将在几周内成功地在这些结构上定植。这意味着这种“可塑形”管网络可以用来制作复杂的支架,甚至可以充当血管网络,而不需要模具或模板。在细胞培养条件下,它们可以稳定数月,作为一种自组装材料,它们具有柔韧性和相对强度——一旦涂上细胞,这种韧性就会稍强一些。
这些管道“可能作为血管或神经元导管来引导神经细胞生长”,他说控制Ulijn纽约市立大学教授。“该系统的一个主要优势是可以实时和时空控制控制管,这意味着直径、长度、膜弹性甚至分支都可以控制。”他指出,这些膜的内外在化学性质上是不同的,这就增加了让两侧对不同类型的细胞有不同的接受能力的可能性,这可能对生长神经导管和血管特别有用。
研究人员还不能确切地确定为什么膜包裹的PA溶液团可以如此容易地转变成管状。但他们怀疑这是一个动力学过程,在这个过程中,任何膜的破坏,例如通过物理接触,允许肽两亲体扩散到水面,在那里它们自组装成一层薄膜,然后扩大破裂,就像肥皂分子薄膜在水面上扩散一样。整个过程对分子相互作用的性质高度敏感:只有少一个赖氨酸残基的PAs与elp结合时不再形成多层膜,而是形成密度更大的纤维聚集体。
斯蒂芬·曼英国布里斯托尔大学的教授说,虽然通过液滴浸泡在第二种成分的浓缩溶液中产生膜有边界的聚电解质胶囊的想法是众所周知的,但他发现新颖的是动力学行为,允许管在张力下通过吸收更多的材料到膜上而伸展。他说:“我预计下一步将涉及使用计算机建模和模拟的理性设计元素。”这并不容易,他警告说:“在几个长度尺度上,分子和超分子之间似乎存在着复杂的相互作用。”
参考文献
Inostroza-Brito等,Nat。化学。DOI:10.1038 / nchem.2349








暂无评论