铁复合物第一次在经典中形成硝酸盐离子的“环试验”已经被隔离。1这项工作背后的团队希望解决金属氧化态的问题,这个问题困扰了化学家半个世纪。但据研究人员称,这种棕色环化合物打破了规则,挑战了国际纯粹与应用化学联合会(Iupac)定义的“氧化态”概念。

硝酸盐离子环测试是本科生无机分析的主要内容。将浓硫酸和硫酸铁溶液倒入试管中,加入待测样品,如果硝酸离子存在,酸和硫酸盐之间会出现一个棕色环。尽管化学家们在100多年前就已经知道了形成棕色环的化合物,但它仍然难以捉摸——没有人能将铁-亚硝基复合物结晶出来。
研究溶液中不稳定分子的化学家对铁的氧化状态感到困惑。建议从铁(I)结合到NO+配体,铁(II)与中性NO配体,甚至铁(III)与NO连接- - - - - -.
也许问题在于我们对事物分类的狂热
佩德罗·萨尔瓦多,赫罗纳大学
现在,彼得Klufers和德国慕尼黑大学的格奥尔格·蒙施培育出了第一批棕色环离子晶体。他们成功的关键是一种大的全氟opinacolato配体的没食子酸反离子。棕色环离子原来是+2阳离子,周围有5个水分子和一个亚硝基配体。
然而,他们的发现并没有为铁的氧化态问题提供一个明确的答案。相反,作者写道,它“挑战了‘氧化态’本身的概念”。
根据Iupac的氧化态规则,2键中的电子被分配给电负性最大的元素。亚硝基已经被认为是一种特殊情况,通常会给出模棱两可的结果。
事物的新变化
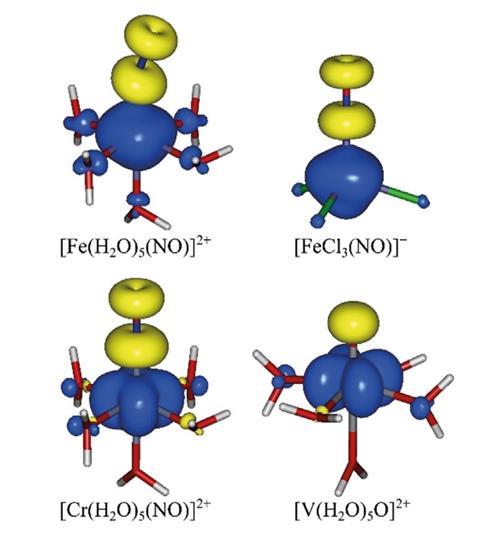
在棕色环发色团中,未配对电子和自旋极化使情况复杂化。“当他们观察哪个电子属于哪个原子时,他们发现自旋向上和自旋向下的电子表现不同。向上自旋的电子会分配给一个原子,向下自旋的电子会分配给另一个原子。佩德罗萨尔瓦多来自西班牙赫罗纳大学,他帮助Klüfers和Monsch确定了环离子的氧化态。
萨尔瓦多有效氧化态法从轨道计算中解开电子分布,以分配整数氧化态。通常,它会得到与使用刘易斯结构的粗略计算相同的数字。但棕色环离子并不是一个明确的例子。根据Klüfers团队使用的轨道计算类型,铁是+1或+3。
棕色环的自旋极化使它不符合Iupac的“赢者通吃”规则。Klüfers说:“尽管alpha-beta(自旋)分离是当代计算方法的标准,但这种情况目前没有被规则覆盖。”
Iupac已经认识到与亚硝基等配体相关的问题约瑟夫Takats来自加拿大阿尔伯塔大学的他是2016年编写该建议的团队的一员。它明确承认存在“氧化态不再被明确定义或变得模糊的限制”,并描述和讨论了此类情况。Iupac团队的另一名成员,帕特里克•麦卡德尔来自爱尔兰国立大学的高韦教授补充道:“进行分子轨道计算并不是了解氧化态的好方法。”“我们决定用一个基于简单直接规则的定义,这个定义可以适用于任何化合物。”
麦卡德尔指出,慕尼黑的研究小组承认“没有强制性的理由反对Fe(I) no+公式,而不是其他任何东西。他说:“这就是从定义中得出的公式。”
萨尔瓦多若有所思地说:“也许问题在于我们对事物分类的狂热。”他补充说,虽然氧化态有助于化学家预测和合理化反应模式,但“对于某些分子,我们认为按照Iupac规则,你无法得到化学直觉告诉你的东西”。
萨尔瓦多说:“在Iupac的任务小组中,他们不太关注计算对模棱两可的情况有什么作用,也许他们有一点关注。”“但化学是非常复杂的,很难用一个单一的规则来解释一切。”
参考文献
1 G Monsch和P Klüfers,Angew。化学。, Int。艾德。, 2019, doi:10.1002 / anie.201902374
2 P卡伦,P麦卡德尔,J塔卡茨,纯粹的达成。化学。, 2016,88, 831 (doi:10.1515 / pac - 2015 - 1204)








1读者的评论