亚硫酸盐还原酶模拟代表工程酶合成的主要进步
化学家首次设计了血红素- [4 fe-4s]本机亚硫酸盐还原酶催化剂也有类似的活动,1风险之前受到酶的结构和功能的复杂性。
亚硫酸盐还原酶(先生)会刺激six-electron亚硫酸盐还原成硫化氢和水-硫代谢在植物和细菌的关键部分,但它的能力是硫化物分解污染oxyanions如高氯酸盐、砷酸和硝酸,使这种酶。
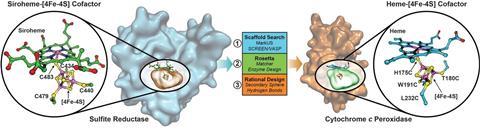
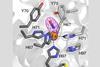
在自然界中,先生是独一无二的代数余子式:爵士作为hemoprotein支架[4 fe-4s]集群的共价结合的sirohaem通过桥接半胱氨酸配体,与赖氨酸和精氨酸残基周围的绑定腔硫化帮助使质子化。然而,众所周知,很难设计合成的酶减少亚硫酸盐作为过程涉及多个氧化还原反应和复杂硫化活性部位与弱绑定。
现在,易路和他的团队从伊利诺斯州大学的我们,已经成功地设计了一个功能模型使用细胞色素c爵士的过氧化物酶(CcP)作为绑定的脚手架fe-4s [4]。共产党本身是一个小的稳定的蛋白质,结合haem-b,配有一个空腔,能适应集群——理想特征重建爵士的催化中心的人工酶、SiRCcP命名。更好的是,他们能够调整的减少活动SiRCcP接近原生的酶,陆承认是“挑战”。
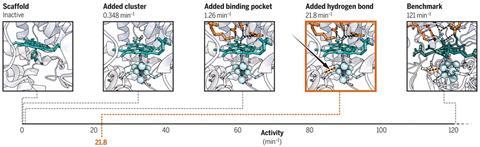
“我们在两部分,”他解释说。“通过引入二次球相互作用,弱非共价债券——我们能够巧妙地调整金属中心的属性。我们还介绍了带正电荷赖氨酸和精氨酸残基为亚硫酸盐稳定,增加亲和力。这是两者的结合,使活动的巨大差别。
SiRCcP承诺使用合成催化剂的功能来执行电子亚硫酸盐还原等反应。2“这就是为什么我们很兴奋的结果,“陆补充道。“现在我们可以让一个活跃的酶与一个非常复杂的中心,类似于本地版本的。
艾琳·多德无机化学家从牛津大学,英国,认为它是一个“非常酷”的结果。而言,这是一个巨大的进步创造一种酶几乎从零开始,事实上工作…这是一个非常重要的工作。然而,SiRCcP活动可能是更好的本地sirohaem一直作为配体,而不是haem-b。“我认为球队的下一步将尝试重复他们在做什么,但通过适当的血红素家族代数余子式,”她说。这将改变架构所以他们可能不得不再次做一个设计,以优化酶。
引用
1 E Mirts等,科学,2018,361年,1098 (DOI:10.1126 / science.aat8474)
2 K兰开斯特,科学,2018,361年,1071 (DOI:10.1126 / science.aau7754)






还没有评论