制药公司阿斯利康(AstraZeneca)和第一三共株式公司(Daiichi Sankyo)押注于一种被称为抗体药物偶联物(adc)的新型抗癌药,而且这两家公司正在取得胜利。今年1月,合作伙伴的药物Enhertu(曲妥珠单抗deruxtecan)被美国监管机构批准用于治疗her2阳性胃癌,此前该药物于2019年被批准用于治疗her2阳性乳腺癌。恩赫图被认为是热门项目,业内专家认为它每年能带来40亿美元(28亿英镑)的收入。
对于阿斯利康来说,这些将单克隆抗体的靶向能力与强效细胞毒药物结合在一起的下一代抗癌药物在治疗癌症方面具有“巨大潜力”,并有望成为大生意。根据公司发言人的说法,该公司致力于投资adc,这现在已经成为该公司癌症治疗多管齐下方法的核心部分。这位发言人说:“我们看到adc在未来将成为多种癌症治疗的基石。manbetx手机客户端3.0。
相信adc将是治疗癌症的下一个重大目标,这是许多业内人士开始采取的立场。自2000年首个ADC获批以来,其中10个增强型抗体已进入市场,其中7个自2017年以来已获批。这一领域的活动正在蓬勃发展。去年9月,吉利德以210亿美元收购了美国ADC开发商Immunomedics,默克在11月以27.5亿美元收购了ADC公司VelosBio, 12月,德国勃林格殷格翰公司以11.8亿欧元(10亿英镑)收购了瑞士ADC公司NBE-Therapeutics。自2012年以来,已经建立了60多个合作伙伴关系,其中约60%的交易发生在2015年之后根分析报告。
与此同时,包括Sterling Pharma Solutions、龙沙(Lonza)和默克公司(Merck KGaA)旗下MilliporeSigma子公司在内的几家公司正在通过收购、设施购买和新建大楼来扩大其生产能力。这是因为ADC管道正在膨胀。根据Roots Analysis的数据,目前约有250种adc正在开发中,在过去五年中增长了三倍,其中近40%处于临床开发阶段。这种繁荣可以从专利上看出来——2009年,adc只有1395项专利申请或授权;咨询公司表示,到2019年上半年,这一数字已超过1.65万。早在2015年,ADC市场价值约为9亿美元。现在,根分析预测,该市场将以每年20%以上的速度增长,到2030年,其价值将超过150亿美元。
据咨询公司称,目前已有超过115家制药公司进入ADC开发领域。这些咨询公司在最近的一份市场报告中说,新的进入者正在进入这个领域,许多公司正在投入大量的努力和资本,以扩展自己的能力和增强服务,包括建立战略联盟。
这种对adc的兴趣源于对癌症免疫疗法和科学进步的日益关注安普梅农他是经济学人智库的高级研究分析师。过去几年,随着辉瑞(Pfizer)、罗氏(Roche)以及最近的阿斯利康(AstraZeneca)等候选公司的批准,该行业已经成熟起来。这推动了人们对此类药物的信心和进一步发展。他还说,鉴于中国市场的巨大潜力,越来越多的公司正在寻找交易和合作机会。
时间轴
抗体药物配合
跳转到
1913 - 1999
从概念到现实
跳转到
2000 - 2018
adc进入市场
跳转到
今天2019 -
adc成为大生意
抗体-药物偶联物的简史
©Ella Maru工作室/科学图片库
1913
保罗·埃利希的神奇子弹概念
adc的起源可以追溯到一个多世纪以前,当时德国诺贝尔奖得主保罗·埃利希(Paul Ehrlich)建议制造将细胞毒性有效载荷与特定结合到患病细胞或生物体的实体结合的物质
1958
第一个重大进展
通过将甲氨蝶呤与靶向白血病细胞的抗体连接而制成的ADC
1975
单克隆抗体定做
César Milstein和Georges Köhler开发了杂交瘤技术——一种产生大量具有预定特异性的单克隆抗体的方法。这一突破,以及后来在抗体工程方面的进展,对治疗性抗体的发展至关重要。米尔斯坦和Köhler因此获得了1984年诺贝尔医学奖
1983
首次成功的ADC人体临床试验
该试验涉及一种ADC,该ADC将一种抗癌胚胎抗原抗体与化疗药物长春氨酸结合
20世纪80年代- 21世纪初
早期adc的安全性和有效性挑战
许多这些问题归因于共轭策略,创造异质和不稳定的共轭
2000年5月
FDA批准第一个ADC
Mylotarg (gemtuzumab ozogamicin)最初由Celltech和惠氏联合开发。这是近15年来首个用于治疗急性髓系白血病的新疗法
2010年5月
麦撤回
Mylotarg (gemtuzumab ozogamicin)在临床试验引发安全问题后,被新东家辉瑞公司撤出美国市场
2011年11月
FDA批准Adcetris
西雅图遗传学公司的Adcetris (brentuximab vedotin)在美国被批准用于复发性经典霍奇金淋巴瘤和复发性全身间变性大细胞淋巴瘤
2017年9月
麦继续
Mylotarg (gemtuzumab ozogamicin)被FDA重新批准用于复发/难治性急性髓系白血病
2018年10月
FDA批准Lumoxiti
Lumoxiti (moxetumomab pasudotox)使ADC批准总数达到5个。AZ药物是20多年来毛细胞白血病患者的第一个新的治疗选择
2019
FDA在一年内批准了三个adc
罗氏的Polivy (polatuzumab vedotin),安斯泰来的Padcev (enfortumab vedotin)和Daiichi Sankyo的Enhertu(曲妥珠单抗deruxtecan)
2020年4月
FDA批准Trodelvy
Trodelvy (sacituzumab govitecan)靶向Trop-2受体,用于治疗已扩散到身体其他部位的三阴性乳腺癌患者
2020年6月
类固醇的Humira
艾伯维宣布ABBV-3373 - Humira(阿达木单抗)2期临床试验阳性结果,这是一种针对与糖皮质激素受体调节剂类固醇相关的肿瘤坏死因子的抗体,用于中重度类风湿性关节炎患者
2020年7月
阿斯利康与第一三共签署60亿美元的协议
AZ同意开发DS-1062——一种人源化抗trop2单克隆抗体,通过基于四肽的连接物连接到拓扑异构酶I抑制剂负载
2020年9月
吉利德同意以210亿美元收购Immunomedics
Immunomedics的产品组合包括Trodelvy (sacituzumab govitecan)
2020年9月
默克公司同意向西雅图基因公司支付17亿美元
合作将开发和商业化西雅图遗传公司的ladiratuzumab vedotin,这是一种针对LIV-1的研究性ADC,目前正处于乳腺癌和其他实体肿瘤的2期临床试验和开发阶段
2020年11月
默克公司以27.5亿美元收购VelosBio
VelosBio正在开发一种靶向受体酪氨酸激酶样孤儿受体1 (ROR1)的ADC,该受体在各种癌症中上调
2020年12月
勃林格殷格翰以11.8亿欧元收购NBE Therapeutics
收购使勃林格获得了NBE-Therapeutics的酶结合平台和候选药物NBE-002,这是一种同样靶向蛋白质ROR1的ADC
2021年1月
Enhertu批准了第二个适应症
FDA批准Enhertu(曲妥珠单抗deruxtecan)用于某些胃或食管腺癌患者
特洛伊木马
adc的前景和潜力在于其定点杀伤的双重作用。这些化合物由一种单克隆抗体通过化学连接物偶联到一种强效细胞毒药物,称为有效载荷。ADC的抗体部分指导治疗,结合到癌细胞上表达的特定靶点,如HER2或CD30蛋白。复合物被细胞内化,在细胞中被降解——在不可切割连接物的情况下,通过抗体和连接物的溶酶体蛋白水解,或者通过pH值等环境差异和具有可切割连接物的特定溶酶体酶降解。这会释放细胞毒性药物,通过结合微管蛋白或破坏DNA来破坏细胞分裂,从而杀死细胞。从本质上讲,这种药物是特洛伊木马。阿斯利康的发言人解释说:“与传统的全身化疗不同,这种高效的方法可以针对肿瘤细胞进行靶向治疗,同时保留健康细胞。”
但是adc的概念一直在挣扎,科学的复杂性导致了前几代人的几次失败。阿斯利康的发言人说,这是因为“早期adc遇到了高毒性和疗效有限等障碍。”但最近的科学进步让制药公司对这一领域更加感兴趣。该发言人说,相对最近,我们看到新一代adc取得了非凡的进展。“整个行业令人印象深刻的生物工程,将有效载荷、更好的连接器技术和更好识别的肿瘤生长关键靶标结合在一起,正在改变ADC领域。”
梅农解释说,对于已经进入拥挤的抗体癌症领域或想要打开肿瘤学领域资金闸门的公司来说,这是简单的算术。他说,这些新药可能会更好地瞄准病变细胞,同时保留健康细胞,这意味着药物质量越好,就越有可能成为重头丸,对制药公司的吸引力就越大。
改善是相当显著的,解释说珍妮Craigen他是英国癌症研究中心的首席转化科学家。她说,人们对如何根据抗原亲和力和内化率等特性来选择单克隆抗体有了更好的理解,而不是从现有药物中开发抗体。
在有效载荷的情况下,也有改进。这些细胞毒性药物,如耳他汀类药物和梅丹素类药物,毒性可高达传统抗癌药物的1000倍,并且需要在肿瘤细胞释放之前保持无活性。克雷根说,早期ADC使用更强大的弹头,但“下一代使用更广泛的有效载荷,许多有效载荷的效力明显低于上一代,这是可能的,因为对ADC稳定性和设计方面有更好的理解。”
这些新药可以更好地靶向病变细胞,同时保留健康细胞
Craigen说,以Immunomedics和Gilead去年批准的Trodelvy (sacituzumab govitecan)为例,它含有拓扑异构酶抑制剂伊立替康代谢物SN-38。“SN-38是具有一半最大抑制浓度(IC)的有效载荷的一个例子50)在纳摩尔范围内,低于第二代有效载荷,但高药物-抗体比使得在癌细胞中达到足够的药物浓度成为可能。”
这就是改进的连接剂化学作用的地方。在过去,不稳定的连接剂导致有效载荷过早释放和脱靶毒性。Craigen说,新的adc不是使用表面暴露的赖氨酸的亲核主氨基或还原结构二硫化物的巯基偶联反应将连接子偶联到抗体上,而是使用位点特异性偶联,如工程侧链半胱氨酸残基或引入非天然氨基酸。Craigen解释说,通过控制偶联位点,这确保了adc更均匀的混合物,提高了药物-抗体比和稳定性,并最大限度地减少了对抗体功能的破坏。简而言之,它们是更有效的药物。
以阿斯利康的Enhertu为例,ADC利用了新的科学,具有新颖的有效载荷和连接器。澳门万博公司它由人源化抗her2 IgG1单克隆抗体曲妥珠单抗组成,通过基于四肽的可切割连接物连接到来自exatecan的拓扑异构酶I抑制剂负载上。这种药物携带大约8个有效载荷,而大多数adc通常携带2到4个弹头。阿斯利康的发言人说:“Enhertu是一项重大的技术进步,其特性包括药物与抗体的高比率,以及一种不仅在血浆和血清中稳定,而且在被内化到细胞时可切割的连接剂。”“更重要的是,我们认为这是前所未有的,这种ADC除了可以杀死已经内化的肿瘤细胞外,还可以靶向邻近的肿瘤细胞。”
胃癌的结果不言自明。在接受过至少两种治疗(包括赫赛汀(曲妥珠单抗))的患者中,恩赫图降低了41%的死亡风险,40.5%的患者肿瘤缩小,而接受伊立替康或紫杉醇化疗的患者肿瘤缩小率为11.3%。数据还表明,接受enhertu治疗的患者中位生存时间为12.5个月,而接受化疗的患者中位生存时间为8.4个月。该发言人说:“阿斯利康的策略是遵循科学,我们相信adc在多种肿瘤类型中具有巨大潜力。”
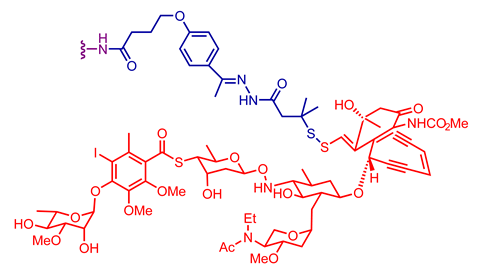
探索临床批准的抗体-药物偶联物中使用的不同抗体、连接子和有效载荷组合
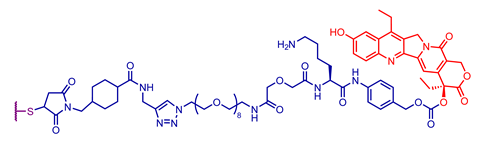
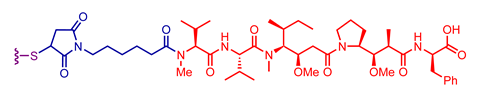
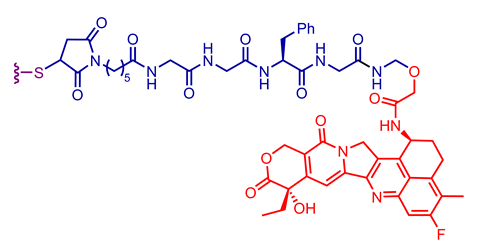
重要的外包
ADC领域的开发人员也严重依赖外包给合同制造商,因为ADC制造复杂,需要先进的制造能力,包括细胞培养和合成化学。Roots Analysis写道,并非业内所有利益相关者都拥有端到端能力或基础设施来支持adc的设计、开发和制造。咨询顾问估计,ADC 70-80%的制造业务是外包的。他们说,这种趋势在未来几年也可能会持续下去,并补充说,随着科学的进一步发展,他们预计ADC制造领域的投资和产能将会增加。
事实上,科学正在进步。目前的限制,包括剂量优化和实体肿瘤穿透,例如,正在审查和解决。有相当多的活动进入先进的共轭化学,包括分支连接剂,目的是装载多个分子的有效载荷。与此同时,对新的细胞毒药物的研究正在进行中,包括小分子、RNA聚合酶抑制剂、蛋白质和酶。克雷根说:“基于吡咯苯二氮卓二聚体的几种化合物正在开发中,它们会产生高细胞毒性的DNA交联,第一个基于吡咯苯二氮卓的ADC预计将在2021年被批准用于弥漫性大b细胞淋巴瘤的治疗。”
也有积极的研究围绕更小的传递格式,如抗体片段和其他新的蛋白质结构。此外,ADC联合治疗是一个新兴的概念,将ADC与免疫检查点抑制剂和表观遗传调节剂结合的研究正在进行中。
然而,最终,科学家们将致力于提高ADC的治疗指数——要么通过提高ADC的效力来降低最低有效剂量(例如高药物-抗体比),要么通过提高肿瘤选择性来增加最大耐受剂量。或者,理想情况下,两者同时发生。
这些下一代药物的前景是巨大的,它超越了癌症领域。adc用于治疗炎症、心血管、代谢和自身免疫疾病的研究已经在进行中。甚至还有人对抗菌药感兴趣,抗体-抗生素结合物使用利福霉素类似物来治疗金黄色葡萄球菌已经在开发中。市场就在那里。如果公司现在对adc不感兴趣,他们很快就会感兴趣的。









暂无评论