尽管辉瑞(Pfizer)和Moderna要求紧急批准其冠状病毒疫苗,但香港和美国的研究人员发现了一种可以对抗病毒的新武器。结合从头设计和定向进化,他们创造了一种与Sars-CoV-2刺突蛋白结合的蛋白质,阻断其感染途径。这种蛋白质在体外可以中和病毒并在仓鼠身上显示出有希望的结果,在少量鼻内剂量后保护它们免受冠状病毒感染。
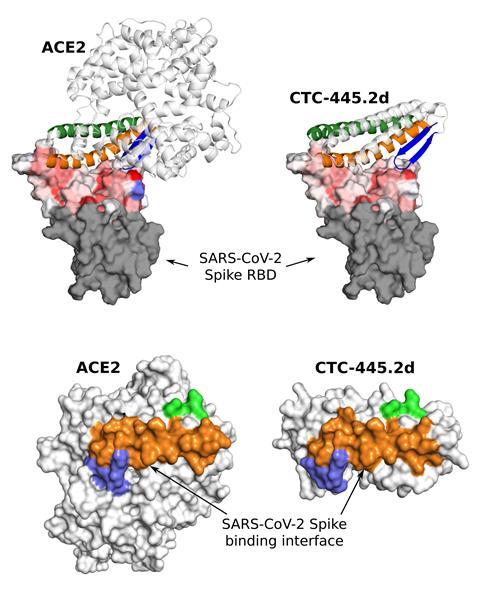
导致Covid-19的冠状病毒Sars-CoV-2感染发生在病毒的刺突糖蛋白与我们细胞表面的ACE2受体结合后。丹尼尔·阿德里亚诺·席尔瓦解释说:“我们现在已经创造了一种伪装的ACE2蛋白质,它与冠状病毒的峰值紧密结合。Neoleukin疗法他领导了这项研究。该公司的专利技术允许他们首先分析现有的生物分子,确定关键结构和功能,然后对具有类似行为的蛋白质进行计算模拟。Neoleukin可以设计一种蛋白质来结合这个目标。Silva补充说:“我们的团队创造了一种蛋白质,它与ACE2中的结合域类似。”“我们诱使病毒与它们结合,然后将其中和。”
这个过程涉及巨大的努力,包括计算和实验。席尔瓦说:“我们从10万个蛋白质设计开始,从中选出了3.5万个结合良好的候选蛋白质。”经过仔细的选择过程,该团队决定合成198种蛋白质,然后测试它们与Sars-CoV-2的结合亲和力。最好的候选基因与人类ACE2基因序列只有30%的相同,而且比人类ACE2基因小5倍。然而,重要的部分保持不变——结合域是相同的,这足以欺骗病毒。
“这是避免负面免疫反应的关键,”他说克里斯•巴尔他是美国波士顿蛋白质创新研究所的蛋白质设计专家。“使用尽可能少的人类蛋白质可以最大限度地降低引发自身免疫性疾病的风险,他们的设计策略可以阻止病毒对治疗产生耐药性的能力。”
一旦研究人员确定了最佳候选基因,他们就利用定向进化提高了它的亲和力和特异性。“这是一种通过有意引入突变来模拟自然选择过程的技术,”解释说吉姆Montclare他是美国纽约大学蛋白质工程专家。在这种情况下,研究小组使用了一种在转录过程中引入随机突变的聚合酶。然后,如果任何变异与目标结合得更好,它们就可以被识别和表征,Montclare解释道。在这种情况下,定向进化产生了一种对Sars-CoV-2具有纳摩尔亲和力的蛋白质,这是对原始候选蛋白质的改进。
Bahl和Montclare都对这些结果印象深刻。蒙特克莱尔说:“他们开发了一种蛋白质,可以从头开始识别具有高亲和力和特异性的Sars-CoV-2刺突蛋白。”“这个过程的速度和保真度是真正的突破;该团队创造了一种起作用非常快的诱饵蛋白质,”巴尔说——整个过程花了不到10周的时间。
第一次体外和体内实验都很有希望。Silva和他的团队给仓鼠鼻内注射了单剂量的蛋白质,然后给它们注射了致命剂量的Sars-CoV-2。他解释说:“通常情况下,七天后它们就会生病,但通过预防性剂量的我们的蛋白质,它们都活了下来。”
新生蛋白在治疗领域仍然是新事物。巴尔说:“这些公司才成立几年,Neoleukin是第一批考虑进行临床试验的公司之一。”不过,这项技术很有前景——通过细胞培养,这种蛋白质可以很容易地大规模生产。巴尔认为,目前的疫苗和单克隆抗体足以对付Covid-19,“但这一工具可能真的有助于对抗未来的大流行”。
参考文献
TW Linsky等,科学, 2020, doi:10.1126 / science.abe0075










暂无评论