化学键不仅仅是共价键、离子键和我们在纸上画的原子间的线。菲利普·鲍尔(Philip Ball)接手了不断扩大的化学联系清单
大约100年前,美国化学家吉尔伯特·刘易斯提出化学键产生于原子间电子对的共用。在1916年的一篇论文中,1他把原子描绘成角上有电子的立方体,并认为它们通过与其他原子共享边缘而在每个角上积累一个电子。这是一个巨大的转变,从流行的概念化学键是静电相互作用引起的电子在原子之间的转移。并不是所有人都喜欢这个想法,但在接下来的20年里莱纳斯鲍林展示了如何用量子力学的新理论来描述电子共享,使刘易斯的图像成为现代化学键理论的核心。
现在仍然如此。但从那时起,刘易斯主题的变体激增。给予键(现在更普遍地称为给-受键),即电子对中的两个电子都来自同一个原子,氢键,即氢原子与孤对的相互作用主要是静电,是标准的本科生课程。然而,部分由于确定分子结构的方法的改进,部分由于量子化学理论的更加复杂,新的成键模式仍在被发现,关于特定的一对原子是否可以被认为是由键连接在一起的争论继续激烈。那么,刘易斯的债券概念在21世纪还适用吗?
将债券
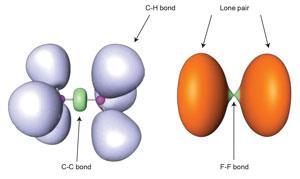
传统上,化学键被分为路易斯电子共享类型(共价键)或更古老的电子交换类型(离子键)。但是,不仅这些区别有时变得模糊,其他新的化学键类型也正在被发现。其中之一就是电荷转移键。2在这里,电子不是简单地共享或转移,而是经历强烈的波动,从而产生一种成键相互作用,让人想起鲍林价键理论中关于共振结构的旧思想。
电荷-位移键并不是稀有和奇异分子的怪癖,但即使在像氟分子F这样的常规结合中也存在2.这在高中化学中通常被描述为共价电子共享的一个简单例子,但纯共价对键的贡献被证明是排斥的。原子可以认为是通过离子和共价形式的共振混合而结合在一起的,如Sason Shaik,大卫Danovich,菲利普Hiberty他们的同事在2005年展示。3.
这一过程的一种思路是,当共价键把原子拉到一起时,它们的收缩导致电子动能的上升,足以抵消键形成的势能稳定;离子·共价共振能恢复了平衡。化学键的其他描述,虽然使用了不同的形式框架来思考化学键,但也将电荷转移键视为与传统共价不同的东西。因此,Shaik, Hiberty和同事们认为电荷转移键“构成了两个经典族之外的一种巨大而独特的键”。2
即使是看似熟悉的债券也会带来惊喜。在配体与过渡金属的结合中,一个原子将一个电子对捐赠给另一个原子的供体-受体键很常见,但在主族元素中有些罕见。后者的一个例子是化合物碳二磷烷,C(PPh3.)2.1961年首次发现磷原子时,人们认为磷原子是通过双键与中心碳原子结合的。但在1978年,人们发现这种分子是弯曲的,而不是线性的。
直到2008年,量子化学计算才被完全理解Gernot frenk而且拉尔夫吨德国马尔堡大学的一项研究表明,实际上它应该被认为是一个供体-受体复合体,其中磷原子以正式的零价激发单态将孤对捐赠给中性碳原子,也就是说,它的价壳电子已经聚集成孤对。4其它这种一般类型CL的化合物2现在已经被发现了,Frenking和Tonner提议称它们为碳原子。5硅和锗的类似物也已被确定用来代替碳。Frenking强调,这种化合物“可以很容易地归入传统的供体-受体键的范畴”——它们只是提供了一个相当奇怪和不可预见的例子。这种化学键实际上也可以看作是电荷转移键的另一种变体。
一种这样的碳,C(BH)2这种异构体特别奇怪,因为它可能以两种异构体形式存在,其中每个原子连接到同一个伙伴,但它们的成键模式不同:在一种异构体中,硼原子与碳原子通过双键连接,分子是线性的,而另一种异构体是具有供体-受体键的碳原子,弯曲成几乎完美的直角。6
填洞
其他熟悉的亲密关系类型也在发生变化。国际纯粹与应用化学家联合会最近提出了一项建议重新定义氢键考虑了对传统上被认为是基本静电相互作用的重要共价贡献的重新考虑。而长期以来被认为在某些方面类似于氢键的非共价相互作用的“卤素键”也有了新的形象。这些键将一个分子基上的卤素与另一个分子基上的电负性原子弱地连接起来,自19世纪以来就已经为人所知,尽管卤素键的术语直到20世纪70年代才开始流行起来。但现在它们被重新定义为s-hole键的子集,s-hole键的负电荷对(通常是Lewis碱基上的孤对,如氮或氧)与卤素上的正电荷区相互作用7-使它们有点类似于供体-受体复合物。
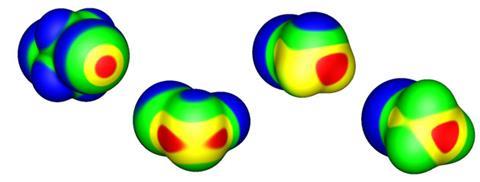
这个正的酒窝或s孔在卤素上,在它的共价键的另一端,首先是由彼得Politzer而且简穆雷新奥尔良大学的研究人员和他们的同事7、8对于一种通常被认为具有电负性的原子来说,这似乎是一种特殊的性质,但这是电子密度积聚在共价键附近这一事实的直接结果——特别是对于更极化的卤素,如溴和碘。这种电荷的再分配伴随着两极之间的负电荷“赤道”带,这意味着两个卤素甚至可以相互静电作用,一个的正电荷部分与另一个的负电荷区域对齐。由两个相互作用原子上电子密度波动的相关性引起的色散力(范德华力)增强了相互作用。
在第15族和第16族元素中也观察到与负电荷位点的非共价相互作用(包括同原子对),它们分别被称为pnictogen键和chalcogen键。事实上,这种结合的例子早在40年前就被发现了,但直到最近才引起人们的关注。正如波利策、默里和同事们所证明的那样,它们也可以被归类为s洞债券。
他们认为s洞的概念“统一了我们对许多看似不同的相互作用的理解,包括元素周期表的不同基团和不同的负电荷位”——其中包括氢键。他们说:“有一种倾向是想把所有这些都视为独立的、不同的互动。”但他们补充说,“这是人为的、误导性的。”

新债券类别或债券变体的数量有时似乎每周都在增加。比如f区元素的f键,9金属原子的平行自旋键,10和Möbius键的扭曲芳香环。11这样的发展刺激了一些研究人员,他们预见到化学家使用纯共价键以外的键来组装原子和分子的方式将发生巨大变化。分子生物学中受体与配体结合中的弱相互作用的重要作用,使我们有充分的理由认为化学家的“松散握把”的任何补充都可能是有用的。事实上,卤素键已经被用于使分子自组装成规则的阵列,用于晶体工程,在光学和电子学方面具有潜在的应用。12它们和硫氧键在生物系统中也被发现,这表明它们可能被用于药物设计。13
联系还是不联系?
化学键中一个关键的不明确之处在于键的强度和长度之间的关系。化学家们习惯于这样的观点:强化学键往往很短,弱化学键往往很长。但这似乎并不总是意味着原子之间足够近,可以成键。出于同样的原因,一些债券似乎可以拉伸到超出正常断裂点而不会“断裂”。
以集群Cu为例3.年代2这种化合物是由美国明尼苏达大学的威廉·托尔曼首先发现的一类有机金属化合物。在这里,两个硫原子分别连接到每个铜原子,形成一个扁平的三角双金字塔。问题是,硫原子是否也沿着星系团的中轴相互结合。的计算罗尔德·霍夫曼美国康奈尔大学的Carlo Mealli、意大利佛罗伦萨有机金属化学研究所的Carlo Mealli和他们的同事似乎认为,14但阿尔瓦雷斯西班牙巴塞罗那大学的研究人员认为没有。在详细讨论了他们的分歧后,15三位研究人员总结道,“也许这个教训不是人们不同意,而是化学键的概念并不是那么简单”——尤其是因为化学键的存在或不存在可以通过几种不同的实验和理论标准来评估,这些标准不一定一致。
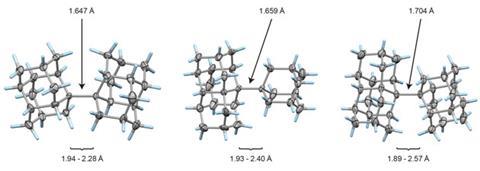
将键视为两个特定原子之间的连接的整个问题,由于最近的工作而变得复杂彼得的妇女不同德国吉森大学教授和他的同事。他们发现,在一些奇异的分子中,异常长的碳碳单键可以持续存在,在这些分子中,它们连接了钻石网络中非常笨重的碎片,称为金刚石烷。16、17碳氢化合物中的碳碳单键通常约为1.54Å长,很少有超过10%的偏差,而在Schreiner的化合物中,碳碳单键可能长达1.704Å——这是迄今为止观察到的最长的键。尽管如此,它们还是相当稳定的:化合物直到200°C以上的温度才会分解。这是尽管事实1.65Å的碳·碳键在一些立体拥挤的化合物之前已经被发现非常弱。
研究人员说,究其原因,是因为金刚烷类取代基在键上彼此相对,有很多并列的表面积,因此色散相互作用有助于将它们结合在一起。实际上,这些表面是“弱胶合”的,因此它们之间的长共价键仍然有效。事实上,Schreiner团队的量子化学计算表明,如果并列的表面足够大,单个连接的碳-碳键即使在超过4Å的几乎超现实的长度下也仍然可以提供明确的结合能。
Schreiner说:“我们常用的成键模型,无论是理论上的还是实验上的,几乎完全建立在对相对小分子的分析上,在这些小分子中,色散相互作用起着相当小的作用。”但他的结果和其他量子化学计算方案“表明,对于越来越大的分子,色散不能被忽视”,他说。
定义的困难
这就提出了一个问题,即这些化合物中的碳-碳键是否真的是传统意义上的键。这几乎就像是在暗示,因为有一根细线紧紧地从一个建筑延伸到相邻的建筑,它一定是把它们绑在一起的。至少,Schreiner的结果挑战了传统的倾向,即将键视为一个孤立的实体,以某种方式从一个分子转移到另一个分子。施赖纳说:“我们一直相信孤立键的情况,因为我们的成键模型最初都是基于双原子系统,我们把它作为参考。”即使是包含非定域键和非经典键的图像,也倾向于将特定原子之间的联系归因于一小部分特定的电子。但施赖纳说,他的发现表明,键“不能再被认为是一个分子到另一个分子的可转移性质,而是取决于整个分子的性质”。
把任何有吸引力的相互作用称为键,都可能把我们带回到“化学亲合力”的概念。
长期以来,如何定义化学键一直是争论的焦点,一些古怪的新化学键类型现在正迫使人们解决这个问题。一些研究人员,尤其是晚期理查德·贝德加拿大汉密尔顿麦克马斯特大学的科学家们认为,两个原子之间的任何吸引相互作用都应被视为键——即使是所有原子之间存在的范德华力或色散力,只要它们能使有关原子稳定结合。Bader的“分子中原子的量子理论”(QTAIM)声称根据分子中电子密度的拓扑结构提供了所有化学键的统一图像,它既能识别并分类每个键。其他人则认为这幅画价值有限。谢克说,把任何有吸引力的相互作用称为化学键,可能会把我们带回到18世纪的“化学亲和”概念。
然而,阿尔瓦雷斯认为,对于范德华相互作用的成键状态是不可能武断的。他最近对“范德华领地”的分析18——通过这些相互作用将原子分开的典型距离——使他得出结论,“取决于所选择的化学元素对,有时取决于它们的氧化状态或其他变量,有时可能存在连续的原子间距离,这使我们无法在成键原子和非成键原子之间建立边界”。
刘易斯的遗产

这一切是否意味着我们应该重新思考化学键的概念?刘易斯这篇开创性论文的百年纪念即将到来,肯定会引发有关这方面的讨论。一些研究人员建议警惕过多的修正主义。谢克说:“我认为最近有很多关于新化学键的炒作,比如卤素键、氮原子键、硫原子键、铍原子键等等。”“我们必须小心,不要陷入这种局面。他认为,将原子间的弱吸引力简单地描述为“分子间相互作用”,而不是赋予它们化学键的地位,是非常清楚和合理的。他说:“我对亲密关系的看法很简单。“相互作用使电子配对,并产生了我们所说的分子,这些分子被这些化学键粘在一起。然后这些分子之间的相互作用形成了介观和宏观物质。这些相互作用通常是弱的,它们通常不涉及电子重组,如电子配对。 To call these a “Z-bond” adds no physical or chemical insight other than being a matter of taxonomy.
“我认为量子化学迄今为止在很大程度上支持了刘易斯电子配对模型,”他断言。“没错,这幅图景已经被拓宽了,也有例外,但正如刘易斯所说,大多数分子都是成键的。我认为电子配对机制将作为成键的主要机制而存在。”
其他人则比较矛盾。阿尔瓦雷斯说:“目前我还没有找到一种明确的方法来对化学键做出一个既实用又包罗万象的新定义。”“也许我们需要开发新的方法来观察原子间的相互作用,或者在原子尺度上可视化技术的改进将提供相关信息来帮助我们开发一个新的系统方案。”但他也同意刘易斯模型仍然“在‘真实’化学的大部分情况下工作得足够好,并且是分析异常情况的一个很好的起点”。换句话说,“将化学键分为‘共价键’和‘非共价键’仍然是我们在高中和大学早期课程中可以教的东西,因为这提供了一个有用的第一个近似”。只是不要相信你在那里学到的一切。
菲利普·鲍尔是一位生活在英国伦敦的科普作家
参考文献
G·N·刘易斯,j。化学。Soc。1916年,38, 762 (doi:10.1021 / ja02261a002)
S Shaik等,化学。2009年,1, 443 (doi:10.1038 / nchem.327)
3 S Shaik等,化学。欧元。J。,2005年,11, 6358 (doi:10.1002 / chem.200500265)
R Tonner和G Frenking,化学。欧元。J。,2008年,14, 3260 (doi:10.1002 / chem.200701390)
5 G Frenking和R Tonner,纯粹的达成。化学。,2009年,81, 597 (doi:10.1351 / pac-con-08-11-03)
6 S R Barua等,化学。欧元。J。在出版社。
7布林克,穆雷,波利策,Int。量子化学,1992年,44, 57 (doi:10.1002 / qua.560440709)
P波利策,J S默里和T克拉克,理论物理。化学。化学。理论物理,2013,15, 11178 (doi:10.1039 / c3cp00054k)
9 S G Minasian等,化学。Sci,2014年,5, 351 (doi:10.1039 / c3sc52030g)
D Danovich和S Shaik,Acc。化学。Res。2013年,DOI:10.1021 / ar4001422
11 C S M Allan和H S Rzepa,j . Org。化学。,2008年,73, 6615 (doi:10.1021 / jo801022b)
12v Amico等,J. Am。化学。Soc。1998年,120, 8261 (doi:10.1021 / ja9810686)
13p奥芬格等人,Proc. Natl。学会科学。美国, 2004,101, 16789 (doi:10.1073 / pnas.0407607101)
14 C Mealli等人,安格。化学。Int。Ed。2008年,47, 2864 (doi:10.1002 / anie.200705296)
S·阿尔瓦雷斯,R·霍夫曼,C·米利,化学。欧元。J。,2009年,15, 8358 (doi:10.1002 / chem.200900239)
16 P R施赖纳等,自然,2011年,477, 308 (doi:10.1038 / nature10367)
17 A A福金等,J. Am。化学。Soc。2012年,134, 13641 (doi:10.1021 / ja302258q)
阿尔瓦雷斯,道尔顿反式。2013,42, 8617 (doi:10.1039 / c3dt50599e)








暂无评论