化学家能制造出像蛋白质一样折叠的分子吗?雷切尔·巴西采访了那些试图创建文件夹的人
折叠的分子是生命的基础。美国威斯康星大学麦迪逊分校的Sam Gellman说:“如果你把生物学看作一个化学家,你就会得出这样的结论:生物学在分子水平上所做的几乎所有复杂的事情都是由一个序列特异性的折叠杂多聚合物完成的。”化学家们一直试图从生物学中学习这些折叠技巧,但根据英国布里斯托尔大学的乔纳森·克莱顿(Jonathan Clayden)的说法,现在的目标不仅仅是复制这些聚合物,而是“用一点化学创造力,比大自然做得更好”。他和其他研究人员利用更广泛的积木,正在创造一种叫做折叠器的分子,这种分子有一天可能会在生物学的折叠游戏中击败生物学。
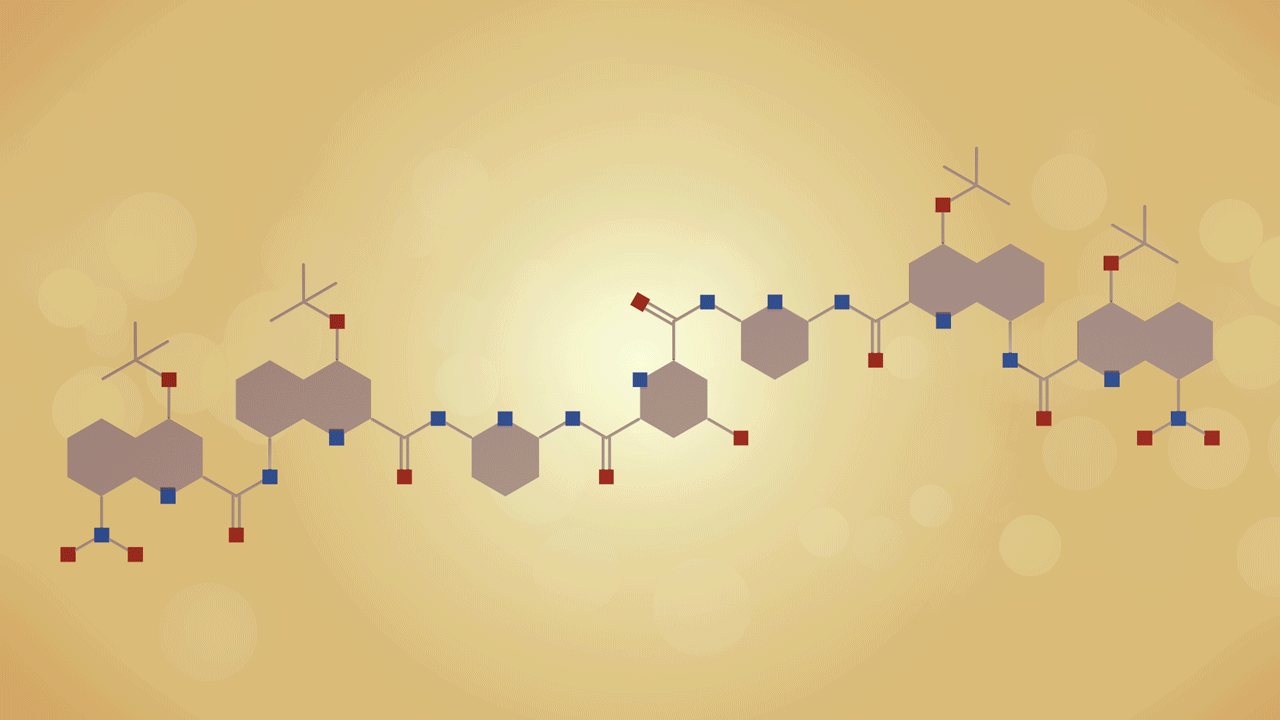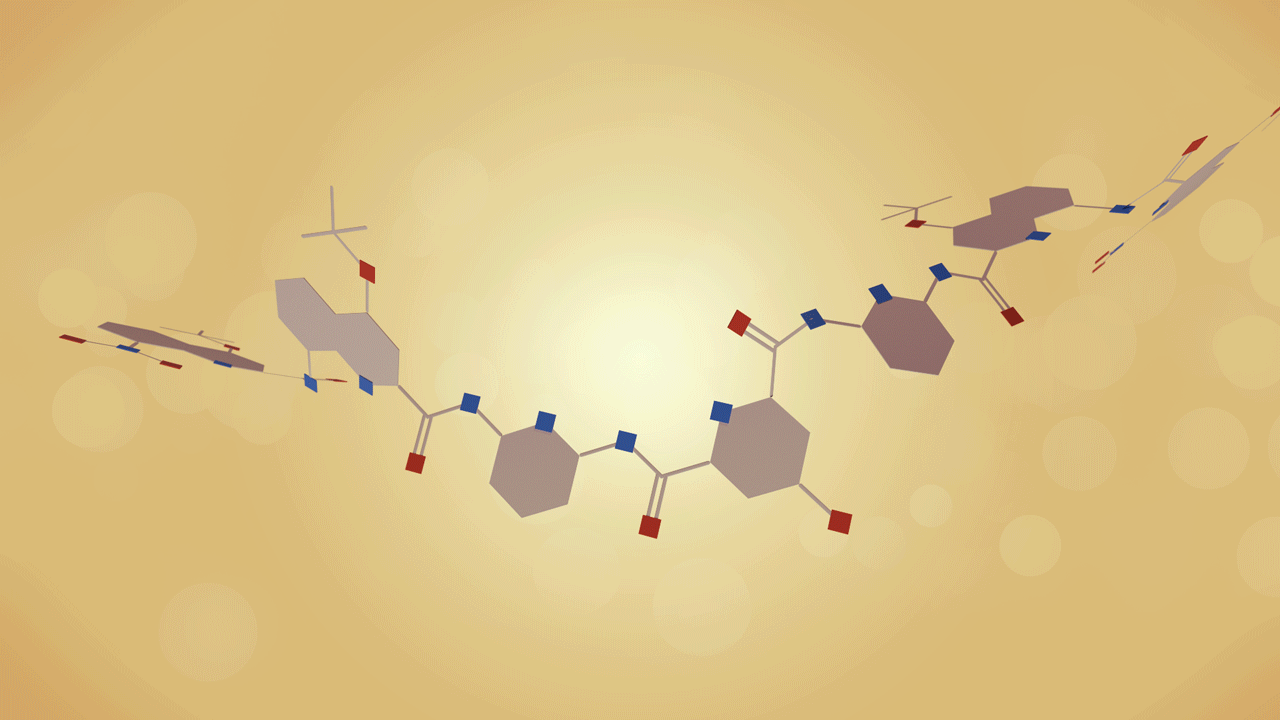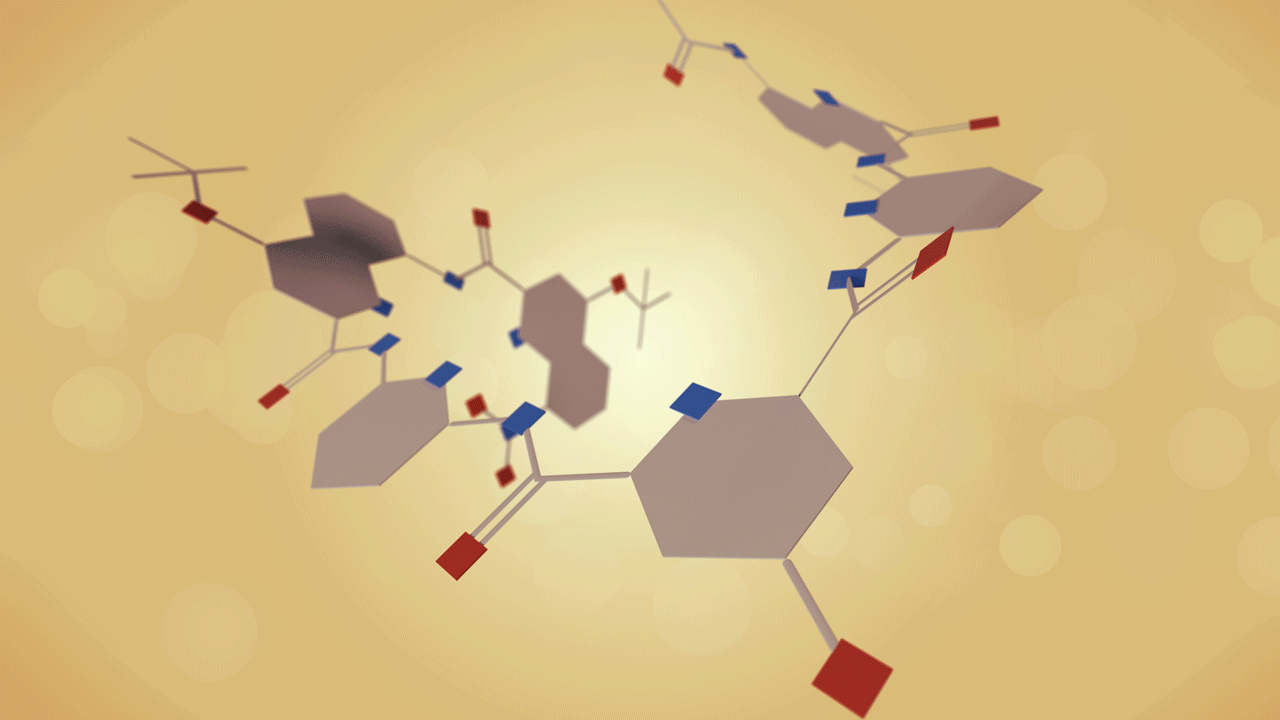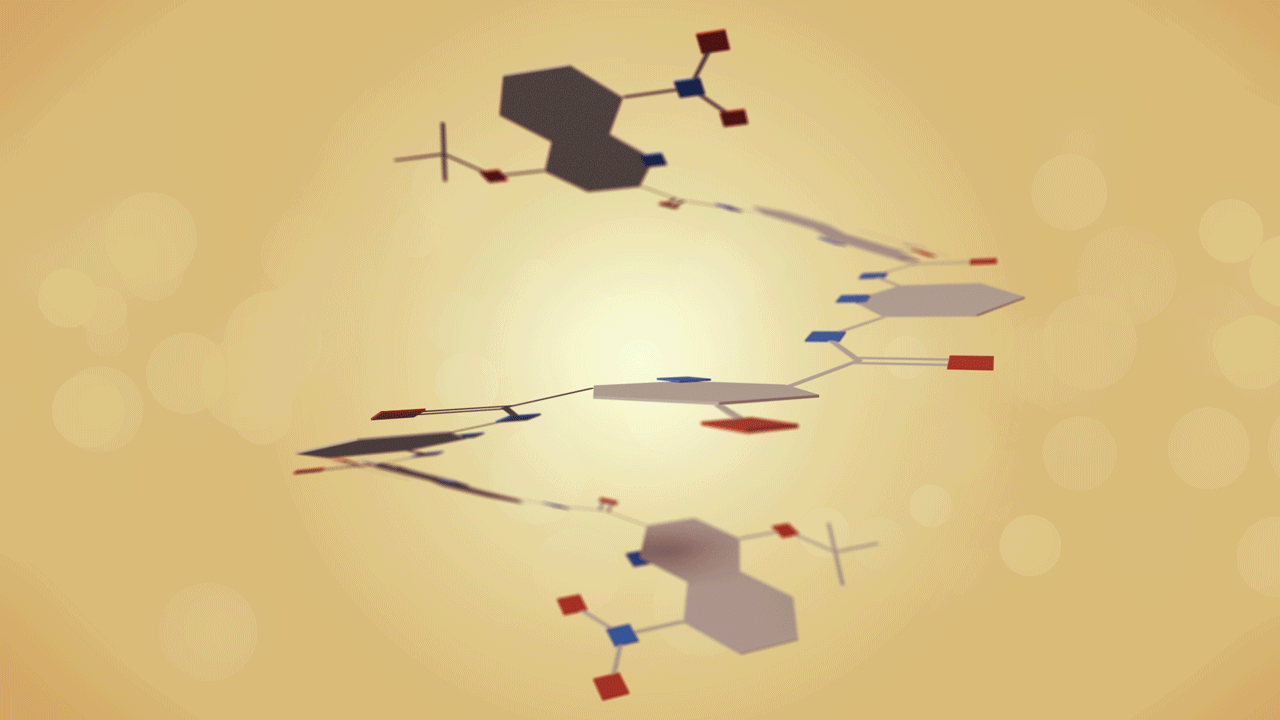
合成可以折叠成二级结构的分子的想法源于20世纪80年代对蛋白质折叠的研究。“蛋白质(建模)专家肯·迪尔(Ken Dill)的模拟是一个关键贡献,”盖尔曼说,他是这种方法的早期采用者,他提出了‘折叠器’这个名字。
目前在美国纽约州石溪大学(Stony Brook University)工作的Dill一直在研究蛋白质折叠,并得出结论,蛋白质折叠过程是由蛋白质中疏水氨基酸和亲水氨基酸并放在一起驱动的。迪尔说:“在此之前,人们一直认为氢键是决定蛋白质结构形成的魔法。”他的合作者罗恩·扎克曼(Ron Zuckermann)当时在制药公司Chiron工作,他的研究表明情况并非如此。他用的是聚类肽N-取代甘氨酸,其侧链附着在主氮原子上,而不是碳原子上。这些分子可以在没有氢键的情况下形成稳定的螺旋,这使Dill和Zuckermann相信折叠主要是由于氨基酸侧链的性质,而主链氢键只是作为额外的“胶水”。
我们追随蛋白质的脚步,但却远远落后
这些想法让Gellman想知道还有什么分子可以像肽一样折叠,他记得在一次会议发言后问Dill,“如果我可以用一个疏水苯乙烯亚基和一个亲水苯乙烯亚基制造聚苯乙烯,它们会折叠吗?”对方的回答是“是的,我想是的。”
对于迪尔和他的合作者扎克曼来说,折叠过程是生命开始的地方,负责化学到生物的转变。虽然流行的理论认为RNA是第一个自我复制的分子,但迪尔认为,在“RNA世界”之前,分子开始折叠一定有一个阶段,他在2017年发表了他的折叠器假说。1他将单体分为亲水(极性)侧链和疏水侧链,用一个简单的计算机模型创建了相似亚基相互吸引的链,发现即使是短链也能坍缩成相对紧凑的结构。
迪尔解释说:“这是一种自然延伸机制,也是选择性和自动催化的。”这是因为坍塌的结构暴露了他所谓的“着陆垫”,用于催化其他新生聚合物,最终产生原始酶。“这意味着,由于疏水极性序列本身的可变性,你将从这个汤中自然地产生一系列潜在的蛋白质功能。”迪尔说,对于生物学来说,你最终需要通过DNA来存储信息,但首先你需要折叠。
那么,如果生物学是关于折叠的,化学家们也能利用这种力量吗?Gellman在20世纪90年代开始尝试,为这种类型的合成分子命名为“foldamer”,通常是10-20个单体单元。“事实证明,聚苯乙烯不能这样做,因为没有人知道如何制造聚苯乙烯,你可以控制单体的位置,所以很多工作最终都集中在聚酰胺上,”Gellman解释道。他的研究重点是β-氨基酸,这种氨基酸的氨基与β-碳结合,而不是与生物学中发现的α结合,但仍然折叠成各种形状的螺旋状,与蛋白质中发现的类似。
其他一些人,比如德国慕尼黑大学的超分子化学家Ivan Huc,用芳香低聚酰胺和带有蛋白质生成侧链的单体设计了更奇异的结构,这些侧链提供了折叠动力。Huc的“苹果皮”螺旋胶囊可以根据单体大小调节直径,酰胺和其他官能团之间的特定吸引和排斥相互作用可以取代到芳香环上。这些折叠体可以在形成的腔中容纳客分子。2Huc说:“用芳香酰胺获得这些形状非常简单,它们完全超出了肽或核苷酸的范围。”
基于对局部构象偏好的理解,设计折叠器仍然是一个主要的试错过程。计算工具正在取得进展,但还没有模拟蛋白质和多肽的工具先进。Huc说:“我们追随他们的脚步,但我们远远落后了。”
催化和药物发现
“一个显而易见的梦想是创造催化版本的折叠器,”最近接受了这一艰巨挑战的盖尔曼说。在某些情况下,酶通过在封闭的口袋中组织分子,将反应速度提高了一百万倍。虽然Gellman还不能制造这种三级结构,但他确实创造了一个折叠器,允许两个官能团彼此靠近地排列,并被拴在一个螺旋上。3.Gellman的折叠体含有a和β氨基酸,包括具有五元环的β残基,通过限制骨架的灵活性来稳定折叠体的螺旋结构。
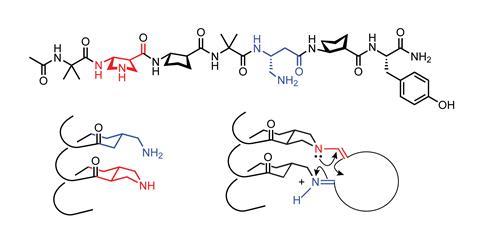
这被用来催化形成大的大环,作为潜在的药物很有用,但很难制造,因为长链分子的两端需要靠得很近才能发生反应。通过将伯胺和仲胺分别连接到β残基上,折叠器能够正确定位末端,并通过醛醇缩合形成碳-碳键,生成12-22个碳环。先前的研究表明,这种折叠器系统可以使类似的反应进行得比使用小分子催化剂快至少100倍。然而,foldamer的性能与酶相比还有很长的路要走。
Gellman和其他人也在研究如何将foldamers作为药物分子,超越生物学。瑞士制药公司Immupharma的首席执行长迪米特里·迪米特里欧(Dimitri Dimitriou)说:“有很多肽有时被用作药物,但它们(在体内)分解得很快。”“如果你能有效地创造出一种稳定的肽类似物,那么(foldamers)就有可能像单克隆抗体产业一样大——这是商业方面令人兴奋的地方。”他有信心在五年内foldamer药物将会上市。
Gellman于2010年联合创立了长寿生物技术公司,开发含有β-氨基酸的肽药物。4他解释说:“这些多肽只有四分之一到三分之一的β残基,但因为它们沿着主干分布,蛋白质水解酶会非常缓慢地切割它们。”该公司将这些螺旋折叠物称为“杂合肽”,并试图设计与G蛋白偶联受体(GPCRs)结合的杂合肽药物,GPCRs是一种跨膜蛋白,当受到外部分子刺激时,可以在细胞内传递信号。他们目前正在进行一项帕金森病候选药物的临床前生物标志物研究。
在冠状病毒疫情关闭期间,格尔曼继续研究可能阻断导致Covid-19的Sars-CoV-2病毒的折叠器。该方法基于2009年开展的一项工作,其灵感来自一种治疗艾滋病的药物。5enfuvirtide是一种含有36个残基的肽,可以有效阻止病毒附着在细胞上,但这种药物的半衰期很短,患者需要每天注射两次。盖尔曼说:“我们制造了对蛋白质水解(消化)的敏感性降低300倍的变体,因为有了a -β(主干),这就是我们试图对冠状病毒做的事情。”
这是一个非常复杂和艰难的挑战,但这是我们正在尝试的
Immupharma还在法国波尔多大学的Giles Guichard的工作基础上,与子公司Ureka一起开发foldamer药物。但它们的折叠体将一些氨基酸换成了尿素,尿素由一个羰基连接两个氨基。“少脲特别适合形成螺旋结构,这些螺旋结构类似于多肽螺旋结构……你可以很好地混合来自尿素(主链)的刚性和来自侧链基团的灵活性,侧链基团可以像氨基酸一样被取代,”Ureka的研究负责人塞巴斯蒂安·古德罗(Sebastien Goudreau)解释道。
作为概念验证,Ureka已经开始研究胰高血糖素样肽-1 (GLP-1),这是一种在胰腺中发现的31个氨基酸激素,可增强胰岛素的分泌,用于治疗2型糖尿病和非酒精性脂肪性肝炎。他们的折叠子用三个尿素残基取代了四个连续的GLP-1氨基酸。6Dimitriou说:“我们已经证明了它的作用,并证明它可以显著延长(小鼠的)半衰期。”这可能意味着一个月只需要一次剂量,如果对消化酶有足够的抵抗力,可能可以口服,尽管迪米特里欧说他们还没有证明这一点。
另外,复杂的蛋白质-蛋白质相互作用,传统上被认为是不可服用的。Huc说,这是一个非常复杂和艰难的挑战。但这是我们正在努力的。”He has been designing foldamer molecules that can match a binding site in terms of their size, shape and proteinogenic side chains as far they can predict, but the final trick is to tether it to the protein. Using disulfide linkers, foldamers bearing different proteinogenic side chains were attached via a cysteine’s thiol side chain. Huc’s achiral foldamer will resonate between a left-handed and right-handed helix, but if it interacts with the protein surface, one version will become more favourable and predominate; this can be detected using circular dichroism spectroscopy.7交互的标志并不意味着紧密的绑定,Huc说,但“从这些交互中,我可以设计”。
动态foldamers
大自然不仅创造了折叠分子,还创造了可以改变形状的分子。例如,当GPCRs对激素和刺激我们味觉和嗅觉的分子做出反应时,它们会发生构象转换。克雷登一直在用折叠器试图重现这些受体的作用。“我们一直在设计具有完全相同特征的分子,例如,当它们选择配体时,它们会改变形状,从而通过分子结构传递信息……这就是我们所说的动态折叠器澳门万博公司。”
与自然不同,Clayden从一种非手性氨基酸开始,α-氨基异丁酸(AIB)。他说:“最终得到的螺旋可以是左旋的,也可以是右旋的,而且实际上可以在它们之间快速地相互转换。”开关机制由折叠器的胺端上的一个大环氨基硼酸基提供。当一个大体积的手性二醇配体加入时,它会形成一个硼酸酯,然后形成一个与胺基相连的甲醇桥。配体的空间体迫使折叠器切换到一个螺旋感。8Clayden已经证明,这些人工受体在嵌入磷脂囊泡时起作用。9“从长远来看,我们希望将这些技术应用到真正的细胞中。我们已经做了一些非常初步的工作。这些动态折叠器可能会导致“智能”药物,可以根据特定刺激独立地打开或关闭细胞内的酶通路。
克莱顿用同样的方法来模仿我们的色觉,这种色觉本质上依赖于视网膜杆中的GPCR受体视紫红质。他解释说:“我们的分子是偶氮苯发色团,它附着在AIB折叠器上,当偶氮苯对光有反应时,AIB折叠器就会改变形状。”在紫外光下,分子会切换到顺式构象,从而在折叠器中产生螺旋感,这就是Clayden所说的“构象光二极管”。10他设想未来的智能化学系统由动态折叠器制成,例如,简单地使用不同颜色的灯来打开和关闭反应,或者从一种对映体产品切换到另一种对映体产品。“我们目前正在研究一种系统,它可以结合催化剂,但在提示转换时释放它。这种想法可以用来释放,例如,酶抑制剂。”
三级结构
迪尔关于生命早期阶段的折叠者假说假设从二级折叠结构转变为我们今天所拥有的蛋白质,其复杂的三级结构结合了由确定的肽序列构成的螺旋和薄片。他说:“在我看来,生物学的真正力量,也是我希望看到的foldamer走向的方向,是将域连接在一起。”但化学家们离这还有一段距离。“大多数蛋白质都有超过100个残基——这对于化学合成来说是相当困难的,”Gellman说。
大多数实验室都在使用固相合成方法,并开始引入自动化,但合成相关单体并非易事。格尔曼说:“小分子合成并不是一个应有的先进领域。”对于多肽化学,许多起始块可以在市场上买到,但对于折叠器则不是这样。“我们可以买到一些我们需要的β氨基酸,但其中许多氨基酸,特别是当它们有环限制其局部构象时,我们买不到,而且我们不知道如何制造。”
大多数蛋白质都有超过100个残基,这对于化学合成来说是相当困难的
然而化学家们正在尝试一些简单的三级结构。一些研究小组已经制造出了模仿锌指结构域的折叠体(锌指结构域是一种能够协调一个或多个锌离子并结合多种生物分子的蛋白质基序)。Foldamers还重新创造了四螺旋束结构,将疏水残基埋藏在核心中。Huc甚至在非极性有机溶剂中形成了螺旋束,这表明这些结构可以在与自然非常不同的环境中形成。11
为了创造更大的结构,Huc建议借用大自然的解决方案:核糖体,细胞的蛋白质工厂。“我的长期梦想是劫持这一机制,教或修改核糖体以产生(非天然的)化学实体。这还没有做到,可能不那么容易。”Ribosomes are complexes of RNA and protein that are able to link amino acids together. They start with a messenger RNA (mRNA) template which base pairs with transfer RNA (tRNA) molecules that carry individual amino acids.
我们需要想想其他大自然根本不会做的事情
Huc在2018年对核糖体的初步研究使用了由日本东京大学的Hiroaki Suga设计的新型RNA酶flexizymes,这种酶能够将非天然氨基酸附着在tRNA上。Huc能够附着一个二肽附加的芳香螺旋折叠体。然后他使用了大肠杆菌核糖体合成折叠体-肽杂交体-折叠体需要展开以通过核糖体出口通道。12虽然核糖体并没有在折叠体内部形成键,但这无疑是朝着这个方向迈出的一小步。
回溯到30年前,问题是生物聚合物及其折叠能力是否独一无二。“化学家已经回答了这个问题:我们可以看出许多不同类型的化学骨架都有折叠的倾向,”Huc说。现在的问题是我们能否制造出越来越复杂的大折叠分子,以及我们能用它们做什么。大自然教会了我们一些技巧,但化学家有更广泛的调色板来研究。Huc建议说:“(我们需要)想想大自然根本不会做的其他事情。”也许关键的发展将在高温材料或微处理器上,谁知道呢?”
雷切尔·巴西,英国伦敦科普作家
参考文献
1 E古谢娃,R N扎克曼,K A迪尔,国家科学院学报美国, 2017,114, e7460 (doi:10.1073 / pnas.1620179114)
2 J Garric, J- m Léger和I HucAngew。化学。Int。艾德。, 2005,44, 1954年(doi:10.1002 / anie.200462898)
3吉文Z C,安德鲁斯M K,刘X,盖尔曼S H,科学, 2019,366, 1528 (doi:10.1126 / science.aax7344)
4r切罗哈等,生物科技Nat。》。2014,32岁的653 (DOI:10.1038 / nbt.2920)
5 S W Horne等,国家科学院学报美国, 2009,106, 14751 (doi:10.1073 / pnas.0902663106)
6 J弗雷莫等,Nat Commun。2019年,10, 924 (doi:10.1038 / s41467 - 019 - 08793 - y)
7米瓦拉德等,Bioconj。化学。, 2019,30., 54 (doi:10.1021 / acs.bioconjchem.8b00710)
8 R布朗等,Nat。化学。2013年,5, 853 (doi:10.1038 / nchem.1747)
9 F列表等,Nat。化学。2017年,9, 420 (doi:10.1038 / nchem.2736)
10 D Mazzier等,j。化学。Soc, 2016,138, 8007 (doi:10.1021 / jacs.6b04435)
11 S De等,Nat。化学, 2018,10, 51 (doi:10.1038 / nchem.2854)
J·M·罗杰斯等,Nat. Chem, 2018,10, 405 (doi:10.1038 / s41557 - 018 - 0007 - x)









暂无评论