Katrina Kramer讲述了Emmanuelle Charpentier和Jennifer Doudna如何开发基因编辑工具,使她们获得了2020年诺贝尔化学奖
生物化学史上最伟大的合作之一开始于波多黎各圣胡安的café。那是2011年Emmanuelle贝纳而且詹妮弗Doudna正在参加一个微生物学会议,该会议有一个小环节专门讨论一个不知名的研究领域:有规律地排列成簇的短回文重复,简称Crispr。仅仅9年之后,两人就共同获得了诺贝尔化学奖。
虽然这两位科学家彼此不认识,但他们在café上偶遇后决定一起探索这座城市。杜德纳回忆道:“我们在圣胡安的老街道上散步,谈论Crispr-Cas9,以及弄清楚它在细菌中可能起什么作用将是多么有趣。上周的新闻发布会.Crispr-Cas在它们相遇前几年才被发现,它是一种古老的细菌免疫系统的一部分,可以检测并切割入侵病毒的DNA。
虽然Charpentier和Doudna除了揭开这个鲜为人知的系统的生化机制之外没有其他计划,但他们感觉他们正在做一件大事。在他们偶然相遇的一年内,他们将展示如何编程Crispr-Cas9以极高的精度切割任何活细胞的DNA——这项工作给科学带来了革命性的变化。1
他说:“没有其他工具能如此迅速地在科学家手中和其他人的生活中产生如此革命性的影响。海伦奥尼尔他在英国伦敦大学学院从事Crispr研究。自成立以来的8年里,研究活动呈爆炸式增长,现在每天都有数十篇关于该主题的出版物问世。已经成立了多家公司专门开发和商业化这项技术。
基因剪刀已被用于生产具有较长保质期的抗缺陷蘑菇,可以在野生种群中传播疟疾抗性的突变蚊子猪的器官可以移植到人身上.Crispr-Cas可以治疗血癌治疗遗传性疾病如先天性失明或血友病
没有其他工具能如此迅速地在科学家手中和其他人的生活中产生革命性的影响
与几十年前的基因治疗概念不同,基因治疗试图用额外的健康基因版本来抵消突变,基因编辑可以完全移除或替换一段与疾病相关的DNA。在早期临床试验中,经过crispr编辑的细胞已经消除了另一种遗传疾病镰状细胞性贫血的症状。奥尼尔说:“它从一种研究工具转变为一种真正的药物,就像陨石撞击地面一样。”
这项技术继续以创新的方式使用。就在几周前,一个包括杜德纳在内的大团队,由梅勒妮奥特美国旧金山格莱斯顿病毒学与免疫学研究所的研究人员表示,他们可以通过基于crispr的测试和一部手机在5分钟内检测出Covid-19。2
由于开发出基因剪刀,来自德国马克斯·普朗克病原体科学小组的Charpentier和来自美国加州大学伯克利分校的Doudna被授予了2020年诺贝尔化学奖。但要了解他们是如何将Crispr从一个相对晦涩的细菌免疫学领域转变为一个世界性的现象,我们必须回到近30年前。
从细菌开始
在1993年,旧金山Mojica当时是西班牙阿利坎特大学的博士生,他在喜盐微生物的基因组中发现了一些意想不到的东西:由短间隔序列分隔的重复的回文DNA片段。很明显,这些基因对细胞很活跃,很重要,但莫希卡不知道它们是干什么用的。通过查阅文献,他发现了一篇1987年的论文,描述了类似的重复DNA模式大肠杆菌.3.
在花了数年时间挖掘出版物和检查原核生物基因组后,Mojica意识到这些奇怪的重复单位在微生物中广泛存在,即使在进化树上彼此相距很远的微生物中也是如此。这表明这些基因起着重要的作用,因为它们在数百万年的自然选择中被保存了下来。2002年,Mojica通过与荷兰乌得勒支大学的分子微生物学家Ruud Jansen的通信,创造了首字母缩写Crispr:有规律地聚集在一起的短回文重复。4
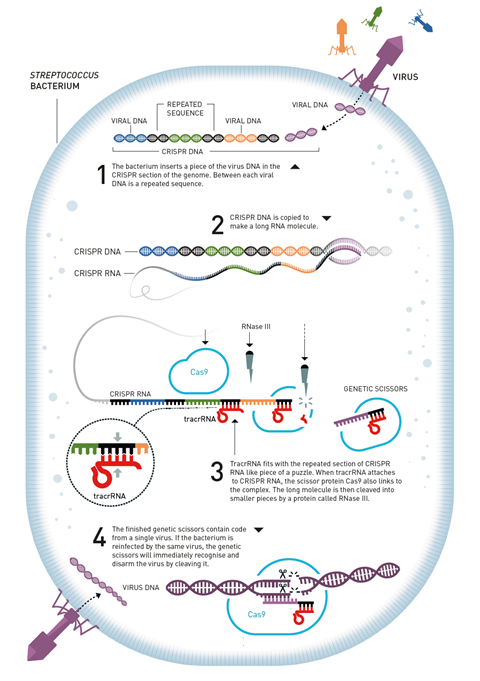
但Crispr实际上做了什么?这一直是个谜,直到莫希卡发现间隔体与噬菌体(感染细菌的病毒)的DNA序列相匹配。他推断,这些基因一定是一个未被发现的帮助细菌抵抗感染的系统的一部分。
科学界对此表示怀疑。莫希卡的研究提出了细菌免疫系统被拒绝了在四家不同的期刊上发表,直到2005年发表。5在Mojica的论文发表后的几年里,研究人员慢慢开始拼凑出这种防御系统是如何工作的。间隔区是来自噬菌体的基因剪切,在细菌被病毒感染后被整合到细菌自身的基因组中。在随后被类似的噬菌体感染时,这些片段被用来识别和破坏病毒DNA。
Crispr序列首先被转录成长RNA分子,然后沿着重复部分被切割成小的Crispr-RNA (crrna),每个crrna包含一个单独的间隔和部分重复。一些crispr相关(Cas)蛋白负责这一激活过程。Cas蛋白附着在crrna上,用它们作为寻找互补病毒DNA的指南。一旦找到匹配,Cas就会切割双链噬菌体DNA。
但这个拼图还缺一块。许多细菌没有产生crRNA片段的多蛋白机制,它们只有一种蛋白质——Cas9。肯定存在另一种激活途径,夏彭迪埃在2011年发现了这种途径。
进入贝纳
夏彭迪埃是在2000年代后期开始从事Crispr研究的。她刚从奥地利的维也纳大学搬到瑞典北部的Umeå大学学习酿脓链球菌这种细菌会导致扁桃体炎和浅表皮肤感染,但也会导致肺炎和危及生命的败血症。Charpentier想通过观察调节基因的小RNA分子来了解这种细菌和其他微生物是如何产生抗生素耐药性的。
与柏林的分子微生物学家合作Jorg沃格尔, Charpentier的团队绘制了所有的地图链球菌的小rna。有一个品种脱颖而出。这显然很重要,因为它大量存在,但人们对它一无所知。研究小组发现它的编码基因在附近链球菌的Crispr序列,暗示了某种联系。
这是一个非常出乎意料的美丽故事,完全出乎意料
实验删除了不同的基因,并观察这是如何影响微生物抵御噬菌体的能力,证明这些反式编码的小rna (tracrnas)是这个过程的重要组成部分。tracrnas帮助生成活跃的、破坏病毒的RNA-Cas复合物。它们与最初由Crispr基因产生的长RNA链中的重复部分结合。Cas9识别这种RNA双工并与之结合,触发核糖核酸酶将其切割成更小的片段,从而创建活跃的crRNA-Cas9系统。
Charpentier, Vogel和他们的团队发现了缺失的激活途径,这是基于tracrRNA和crRNA之间的相互作用。这是一个激进的想法——rna不像蛋白质那样是团队成员,它们经常一起工作。
在经过一年的证据整理来支持这一假设之后,Charpentier、Vogel和他们的团队在2011年发表了研究结果。6夏彭迪埃还在荷兰的一个Crispr会议上展示了这些成果。微生物学家兼会议组织者说:“这是会议的亮点——一个出乎意料的美丽故事,来得太突然了。约翰·范德奥斯特在一个2016年采访自然.
Charpentier知道她可能会有重大发现,但她需要结构生物学家的帮助。因此,她带着一个计划参加了2011年在波多黎各举行的微生物学会议。“我想找詹妮弗,问她是否有兴趣破译Cas9的结构,”Charpentier解释道采访《Crispr期刊》去年。
从有趣到发现
杜德纳在采访中说:“当我刚开始做这件事的时候,我认为这是一个有趣的小副业。最近接受了美国国立卫生研究院的采访她在2006年首次涉足Crispr研究。她在伯克利的同事、微生物学家吉利安·班菲尔德(Jillian Banfield)曾告诉她有关神秘的Crispr序列的事情。杜德纳对此很感兴趣。但她说,涉足Crispr研究也让她感到有点内疚。“我得到了美国国立卫生研究院(NIH)和霍华德健康医学研究所(Howard Health Medical Institute)的资助,我想:我怎么才能真正证明这个关于细菌免疫的疯狂小项目是正确的呢?它可能与人类健康毫无关系。””
就在10年前,Crispr还是一个相对鲜为人知的领域。社区很小,一间会议室就能容纳下所有人。“那时候,如果我去某个地方说‘我正在研究细菌免疫系统’,他们会非常困惑地看着我,‘你为什么要做这个?杜德纳回忆道在上周的伯克利新闻发布会上.
2011年在波多黎各举行的会议上,只有一个会议是专门讨论Crispr的。Charpentier和Doudna都出席了这次会议。虽然他们知道彼此的工作——在那个时候,这个领域的每个人都知道每个人的工作——但他们还没有见过面。
但当他们开始交谈时,他们很快意识到他们的科学专长是互补的。杜德纳说:“我们进入Crispr领域的背景完全不同。manbetx手机客户端3.0.她是一名训练有素的微生物学家,主要研究对人体有害的细菌。我的研究一直专注于分子,尤其是RNA,并试图了解它在生命进化中的作用。”
在2017年采访《卫报》,杜德纳回忆起夏彭蒂埃那种富有感染力的兴奋。“那时我就有一种直觉,觉得这真的很有趣。”As soon as the two were back in their respective labs – Doudna and her team on the US West coast, Charpentier and her group split between Sweden and Austria – they started working together.
他回忆说:“我们有很多电子邮件和Skype对话,也有很多东西在大西洋两岸来回发送。马丁Jinek他当时是杜德纳团队的博士后研究员,也是2012年这项开创性研究的联合第一作者。由于三个实验室之间的时差,“在研究快结束的时候,它基本上变成了一个昼夜不停的操作”,Jinek解释道。
Charpentier在采访中说:“这次合作短暂而激烈。接受诺贝尔基金会的采访奖项公布后不久。“我们明白,联合起来很重要,我们需要加快步伐,因为这个故事很棒。”
但一开始,实验并不成功。纯化的Cas9蛋白和一小段crRNA的组合没有任何作用。“我们以为我们已经拥有了所有的成分,但DNA并没有被切割,”Jinek说manbetx手机客户端3.0.“然后,当我们将tracrRNA加入到混合物中,事情突然开始起作用了。对我们来说,这是一个重大时刻。”The tracrRNA, it turned out, didn’t just play a role in activating the system, it was also needed for its smooth running.
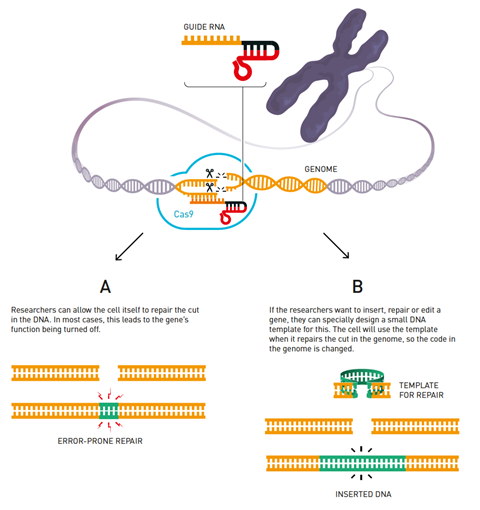
杜德纳解释说:“根据定义,Cas9是一种可编程酶:它使用不同的RNA序列来识别DNA。”“然后我们意识到,我们可能可以设计一种单一的指导RNA,用于编程Cas9。”
这正是他们所做的。他们将crRNA和tracrRNA融合成一个分子——一个20个碱基对的序列,现在被称为引导RNA。当它像单个分子一样有效工作时,研究小组意识到他们创造了一个系统,只要改变RNA模板,就可以在任何他们想要的地方切割DNA——这是一个顿悟的时刻。杜德纳说:“马丁当时在我的办公室里,我们正在谈论他的数据,我们互相看着对方,意识到这可能是其他类型细胞中的一个非凡工具,因为它能够触发DNA修复,从而实现基因组编辑。回忆在伯克利新闻发布会上
这个想法是革命性的——也许对某些人来说太过革命性了。大约在同一时间,Charpentier, Doudna和同事们致力于发表他们的结果,由本土知识VirginijusŠšnys立陶宛维尔纽斯大学的一项研究也表明,Cas9系统可以在预定位置切割DNA序列。Šikšnys将论文发送到细胞,在哪里被拒绝了没有审查。几个月后,这篇文章终于被另一家杂志接受。8Charpentier和Doudna比较幸运,他们开创性的研究被接受了科学.1
“我们在Crispr会议上公布了接近发表时间的结果,非常令人兴奋,”他说Krzysztof Chylinski他是这篇论文的另一位联合第一作者,当时是夏彭蒂埃在维也纳小组的一名博士生。虽然基因工程并不新鲜,但Crispr-Cas将使科学家能够以全新的精度操纵DNA,同时使这一过程更简单、更快、更便宜。
从几年到几个月
“当人们意识到DNA是什么以及生命的密码时,他们就开始思考基因组工程了,”他说Audrone Lapinaite他最近在杜德纳的实验室完成了博士后研究,现在在美国亚利桑那州立大学管理着一个研究团队。当Crispr技术问世时,基因组编辑领域有两个主要参与者:锌指核酸酶而且转录激活子样效应核酸酶(取得)。
Lapinaite解释说:“这两个系统最大的问题是,要将它们定位到特定的基因组序列并不容易,因为你必须重新设计蛋白质,找到感兴趣的基因组位置并执行切割。”这种工程设计需要付出很多努力,而且不是小事。有了Crispr,最大的突破是蛋白质总是一样的,你可以很容易地产生大量蛋白质。”
奥尼尔说,在Crispr出现之前,“我花了两年时间——这是一项伟大的成就——得到了两只转基因小鼠。现在这可以在几个月内完成。”Scientists now only need to produce a custom RNA molecule – a routine procedure – that matches the DNA sequence they want to target.
对任意位置切割DNA的自由的唯一限制是原间隔相邻基序(Pam)的存在,它是靠近目标序列的2到6个碱基对的短序列。Pam对于Cas9识别其目标非常重要。它阻止细菌切割自己的DNA,因为它们使用的Pam是噬菌体特有的。但由于来自不同细菌种类的Cas蛋白识别不同的Pam序列,即使是这种限制也在慢慢消失。
Crispr-Cas9系统只能切割双链DNA,不能改变双链DNA。实际的编辑发生在之后,依赖于细胞自身的修复机制。细胞可以通过直接将断裂的末端重新融合在一起来修复DNA,这通常会删除或插入一些碱基对,并往往会关闭基因的功能。
在另一个过程中,细胞寻找同源DNA序列作为修复的模板。研究人员可以利用这一机制,通过向细胞提供小的DNA模板片段,在断裂处插入或改变序列。由于修复机制只存在于分裂细胞中,因此编辑非分裂细胞(例如神经元)的基因仍然具有挑战性。
这个想法传播开来
“对我来说,一个预示未来的重大迹象是,就在半年之内,冯张而且乔治教堂这表明我们的建议确实有效。”起初,人们并不清楚Crispr-Cas9是否能在非细菌细胞中起作用。最初的想法之一是简单地使用该系统使细菌更具噬菌体抗性,这本身对生物技术来说是一个巨大的福音。但张、丘奇和杜德纳本人很快就证明了Crispr-Cas9没有这样的限制,证明基因剪刀在小鼠和人类细胞中同样有效。9、10、11
在接下来的几年里,该领域经历了一系列活动,没有任何减弱的迹象。吉内克说:“我们当时并没有意识到,社会上有多么迫切地需要可以随时应用的工具。”一些科学家开始改造农作物,使它们更能抵御病虫害。另一些人则在设计小鼠和大鼠作为人类疾病的模型,而许多人则热衷于解决遗传疾病的可能性。
但是,能够如此简单和精确地编辑基因组也意味着有可能改变生物体的生殖系,即将遗传物质传递给后代的细胞。这是第一次被证明122014年在猴子身上,一年后在不可存活的人类胚胎上。13
杜德纳在接受美国国立卫生研究院采访时解释说:“如果人类生殖细胞的变化足够大,它将真正改变人类进化的进程。”她在一份报告中说:“我发现自己有很多个晚上躺在床上睡不着觉,想着我参与开发的这项技术在这种方式上的潜力。2019年谈谈基因编辑的未来.自2014年以来,她一直公开倡导负责任地使用基因编辑。
伦理难题
但在2018年11月,杜德纳收到了一封主题为“婴儿出生”的电子邮件。它来自中国深圳南方科技大学(SUSTech)的生物物理学家贺建奎。她在2019年的演讲中回忆道:“他在一封非常简短的电子邮件中告诉我,他参与了一项临床研究,他们使用Crispr-Cas9改变了实际出生的婴儿的基因组。”
国际社会站出来强烈反对Crispr的鲁莽使用,这是非常非常重要的
几天后,建奎公开宣布他破坏了CCR5基因,该基因允许艾滋病毒感染双胞胎女孩的细胞。这显然是为了保护婴儿免受病毒感染,因为他们的父亲是艾滋病毒阳性。但是,虽然自然的CCR5突变确实提供了一些艾滋病毒保护,但基因编辑是不同的,甚至从未在动物身上进行过测试。
杜德纳说:“我非常震惊manbetx手机客户端3.0.“我知道这件事会引起很多关注,国际社会站出来强烈反对鲁莽使用对人们健康不负责任的技术是非常非常重要的。”事实上,科学界严厉谴责了建奎的行为,并于2019年12月被判入狱监禁三年因为非法行医
这一丑闻使基因编辑成为人们关注的焦点。公众的认可冷却到越来越多的人开始担心这项技术而不是对它的可能性感到兴奋。这也影响了研究界,他们希望帮助防止患有毁灭性遗传疾病的人将其遗传给他们的孩子。奥尼尔回忆说:“它让像我这样的人回到了以前,那实际上是一段相当可怕的时期。”
与此同时,杜德纳说:“全球已经做出了非常好的协调一致的努力,以确保我们不会再看到这种不计后果的使用。”Lapinaite说,不仅需要全国性的讨论,还需要世界性的讨论。去年,世界卫生组织推出了一个追踪人类基因组编辑的注册表活动。
尽管存在专利纠纷,但仍取得进展
更积极的是,Crispr研究已经出现了首个临床成功案例。去年,维多利亚灰色成为美国第一个接受基于crispr疗法的镰状细胞病遗传疾病患者。她接受了骨髓移植,其中含有大约20亿个她自己的细胞,这些细胞经过编辑,重新启用了胎儿时期产生血红蛋白的基因,以弥补她有缺陷的成人血红蛋白基因。虽然现在完全评估治疗的成功还为时过早,但格雷已经停止了典型的剧烈疼痛,也不再需要输血。
开发Crispr用于此类临床应用以及作为生物医学工具的巨大动力。夏彭迪埃和杜德纳都成立了几家初创公司,专注于将这项技术商业化。
但将Crispr-Cas推向市场的热潮也已引发相当复杂的专利纠纷一方是两位获奖者和伯克利,另一方是张和布罗德研究所。虽然伯克利大学更早申请了在无细胞系统中使用Crispr-Cas9的专利,但布罗德大学在真核细胞中使用该技术的专利最先获得批准。到目前为止,这两项专利被允许并排存在,但争议仍在继续。
与此同时,该领域在许多方面都在向前推进。其中一个挑战是将Crispr-Cas送入特定细胞。传统上,整个系统是作为一个DNA编码片段引入的,它使细胞能够产生自己的Cas9蛋白并引导RNA。然而,这会使细胞充满大量Cas9蛋白,增加脱靶活动的机会。科学家们已经开始测试病毒样颗粒是否可以将完全组装的引导RNA-Cas9复合物注入细胞。这可以更好地控制每个细胞Cas蛋白的数量,甚至可以根据病毒颗粒的受体靶向特定的细胞类型。
研究人员也在探索Crispr-Cas的变体,14有的用不同的活动进行RNA-cutting或者单链切口,例如。最新的精确技术是DNA碱基编辑器,这是一种经过生物化学修饰的Cas酶,可以在不切断DNA链的情况下将单个碱基对转化为另一个碱基对。这可能有助于治疗由点突变引起的遗传疾病,比如儿童的早衰症.
人们不断发现新的Crispr-Cas系统。最近,杜德纳小组描述了他们在巨大噬菌体中发现的微小CasΦ。15“这些细菌病毒往往有自己的Crispr系统,以杀死争夺同一宿主的其他病毒,”解释说部队Al-Shayeb他是这项研究的联合第一作者。尽管只有Cas9的一半大小,Crispr-CasΦ系统的功能却一样强大。Al-Shayeb补充说,如此小的体积可以更容易地输送到细胞中。
从合作到庆祝
2012年合作之后,夏彭迪埃和杜德纳的兴趣出现了分歧。杜德纳解释说:“艾曼纽很想继续研究导致人类疾病的细菌途径。”“在我自己的工作中,我们深入研究了Crispr的分子和机制。”
尽管如此,两人仍然处于Crispr热潮的中心,并获得了大量备受瞩目的奖项,包括2015年300万美元(230万英镑)的生命科学突破奖,2018年100万美元的Kavli纳米科学奖(两人与Šikšnys分享),以及2020年10万美元的沃尔夫医学奖。在2015年,时间杂志将他们评为100位最具影响力的人物之一。
夏彭捷和杜德纳也经常被认为是诺贝尔奖的候选人,并在几年的预测调查中领先。Charpentier在采访中说:“科学家和非科学家都说,Crispr-Cas有一天会获得诺贝尔奖,但我们并不清楚。诺贝尔奖宣布后的新闻发布会.我接到电话时非常激动。”
夏彭蒂埃坐在柏林的办公室里接到了来自斯德哥尔摩的电话,而杜德纳接到的是不那么传统的叫醒电话。当时是加州凌晨2点53分,她的手机嗡嗡作响。“是海蒂·莱德福,一个自然杜德纳在接受《华尔街日报》采访时表示:“这是我过去和记者交谈过的伯克利的媒体团队.莱德福德想要一个关于诺贝尔奖的评论。“我以为她打电话来是想让我对其他人获奖发表评论。于是我问她:“谁赢了?”她说:“嗯,你!“‘
Charpentier和Doudna强调,Crispr是一个完美的例子,说明解决方案来自意想不到的地方。Charpentier在新闻发布会上说,这不是为了发表文章和积累影响因子而进行科学研究,而是为了相信一个一开始可能不那么令人兴奋或流行的项目。
2020年的化学奖也是第一个授予全女性团队的奖项。杜德纳对伯克利团队说:“这对我来说意义重大,让我想起了自己的童年。”“从小到大,我不止一次被告知,女孩不做化学实验。”在诺贝尔新闻发布会上她补充道:“我认为许多女性都有一种感觉,不管她们做什么,她们的工作永远不会像她们是男性那样得到认可。”我希望看到这种改变,我认为这是朝着正确方向迈出的一步。”
但最令杜德纳兴奋的是伯克利大学为诺贝尔奖得主预留的专用停车位。她笑着说:“18年后,现在我终于可以在校园里停车了。”
参考文献
1 M Jinek等,科学, 2012,337, 816 (doi:10.1126 / science.1225829)
2 P Fozouni等,MedRxiv, 2020, doi:10.1101 / 2020.09.28.20201947
3石野Y等,j . Bacteriol。, 1987,169, 5429 (doi:10.1128 / jb.169.12.5429 - 5433.1987)
R詹森等,摩尔。Microbiol。, 2002,43, 1565 (doi:10.1046 / j.1365-2958.2002.02839.x)
5 F J M Mojica等,J. Mol. Evol, 2005,60, 174 (DOI:10.1007 / s00239 - 004 - 0046 - 3)
C Pourcel, G Salvignol和G Vergnaud,微生物学, 2005,151, 653 (doi:10.1099 / mic.0.27437-0)
7 E Deltcheva等,自然, 2011,471, 602 (doi:10.1038 / nature09886)
8g伽修纳斯等,Proc。国家的。学会科学。美国, 2012,109, e2579 (doi:10.1073 / pnas.1208507109)
9 L聪等,科学, 2013,339, 819 (doi:10.1126 / science.1231143)
10 P马里等,科学, 2013,339, 823 (doi:10.1126 / science.1232033)
11m Jinek等,eLife, 2013,2, e00471 (DOI:10.7554 / eLife.00471)
牛勇等,细胞, 2014,156, 836 (doi:10.1016 / j.cell.2014.01.027)
13 P梁等,蛋白细胞, 2015,6, 363 (doi:10.1007 / s13238 - 015 - 0153 - 5)
K S Makarova等,Nat. Rev.微生物。, 2020,18, 67 (doi:10.1038 / s41579 - 019 - 0299 - x)
15 P波许等,科学, 2020,369, 333 (doi:10.1126 / science.abb1400)













1读者的评论