没有空间让蛋白质变性,但反应物仍然可以通过
以色列的科学家们发明了一种新的固定化酶的方法——用金属金包裹它们。笼子里的酶在极端pH值和高温下都很稳定,其中一种酶在pH值13时存活。
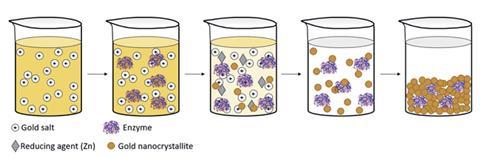
固定化酶服务于化学的几个领域,从有机合成到生物技术。固定化的主要目的是通过阻止酶的氨基酸链展开来稳定酶,并使生物催化剂易于回收和重复使用。典型的固定化技术将酶锚定在支架上。然而,不可避免的是,至少有一些酶会分离,它们仍然容易受到外部环境的攻击。
现在,大卫Avnir和耶路撒冷希伯来大学的Yael Baruch-Shpigler证明了金属金笼子可以确保酶的任何部分都不与外部环境接触。这对研究搭档将酶与阴离子金盐混合,然后用锌还原剂形成金纳米晶体。这些纳米晶体聚集成一个多孔的金笼子,允许反应物扩散到酶和离开酶。金通过硫醇、胺、亚胺和羧酸阴离子等表面氨基酸残基附着在酶上。
Avnir和Baruch-Shpigler在五种工业上重要的酶上测试了这个概念:葡萄糖氧化酶,胶原酶,l-天冬酰胺酶,辣根过氧化物酶和漆酶。金笼子成功地提高了这五种酶的热稳定性。l-天冬酰胺酶可以在pH值为13的条件下发挥作用,这种条件通常会立即杀死这种酶。
Avnir解释说:“变性意味着三维结构以不同的方式开放和改革。”“金笼子非常坚硬,根本没有空间让分子进行导致变性的运动,这就是为什么它被保护起来了。”
“考虑到黄金金属的化学惰性,这种三维结构很有希望作为一种新型的酶诱捕基质,”评论道Shengqian马他在美国南佛罗里达大学设计先进的多孔材料。
其中一种被包裹的酶在高温下甚至表现出更高的活性,这是通常只在嗜热酶中看到的特性。“尤其令人兴奋的是,在25°C的高温下,胶原酶-金结构显示出比天然酶更强的活性,”他说伊莫金里德尔他在英国曼彻斯特大学(University of Manchester)的研究重点是构建用于封装蛋白质的非天然材料。“这凸显了封装酶的潜力,它不仅是一种更具选择性、环境可持续性的化学转化途径,而且是一种更快速的合成途径。”









暂无评论