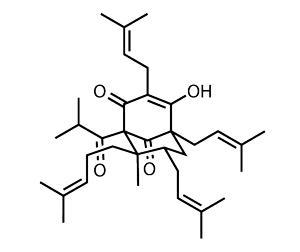
对圣约翰草的研究已经发现了几种生物活性成分,但主要成分是hypperforin,一种有效的几种神经递质抑制剂。1化学上,hyperperforin是一种多环聚戊烯酰间苯三酚,通常由一个双环壬烷[3.3.1]组成,修饰有几个类异戊二烯侧链。虽然这种结构赋予了超穿孔素的效力,但它也带来了相当大的缺点——特别是低水溶性和对氧化的高度敏感性。
药物化学面临的挑战是相当明确的——提供能保持天然产物功效的超穿孔素类似物,但这些类似物更稳定且更可溶于水。然而,要做到这一点,需要一种有效的通往目标的路径,为选择性和灵活的推导提供机会——这是一个团队所领导的马特Shair美国哈佛大学(Harvard University)的研究人员提供了。2
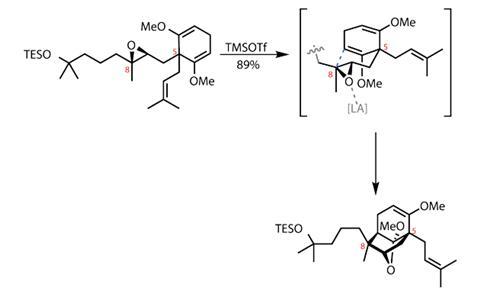
从问题的核心开始,美国团队研究了两个片段,这两个片段将提供复杂的双环壬烷体系。派生的香叶醇提供了起始材料和不对称性,但在合成的早期,他们使用了一种我宁愿留在架子上的试剂醋酸汞.尽管氧汞化反应的副产物远不如其他有机汞化合物毒性大,但这种反应的温和性和实用性使它保持了相关性。
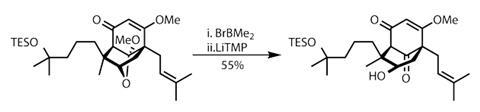
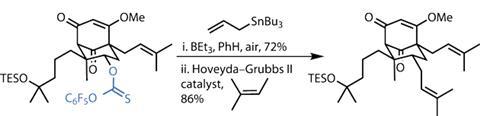
第二个片段还需要一种具有潜在毒性的碘化钡试剂,但这对于增加烯丙化反应的选择性是必要的。跳过的二烯脱质子后形成一个戊二烯阴离子,可以与之反应prenyl氯在多个地点,但使用新制备的碘化钡将反应集中在所需的位置。在同一中心的第二个去质子化促进了与第一个片段的平滑耦合,直接返回环化底物。
循环事件本身更直接-使用公共路易斯酸环氧化物的活化引发重排反应,在反应过程中形成两个环,具有优异的立体选择性和整体反应效率(图1)。
保罗·多赫蒂(Paul Docherty)是一位生活在英国雷丁的科学作家和博主
参考文献
(DOI: 10.1007 / s002130000625)










暂无评论