将强大、成熟的化学与创新的反应相结合,可以做出优雅而简洁的合成
1675年,艾萨克·牛顿给他的朋友罗伯特·胡克写了一封信,要求对他的论文进行批评,并发表了他现在著名的评论:“如果我看得更远,那是因为我站在巨人的肩膀上。”近350年后,这句格言依然正确。尽管当今出版物中大量的引用证明了天然产品合成从未真正独立的观点是错误的,但学术团体经常试图在策划活动时尽可能多地使用自己的方法,有时会产生有害的影响。工业化学家在利用他人的优秀成果方面远没有那么害羞。没有同样的发表压力,他们的首要任务是制造分子,而不是自我推销或为了创新而创新。
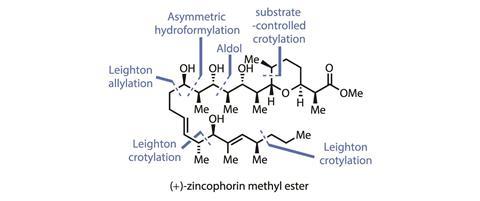
美国纽约哥伦比亚大学James Leighton团队最近的锌磷甲酯全合成是一个很好的例子,说明了一个学术团队将新旧化学结合在一起,以务实和实用的方法处理复杂的天然产物。12015年,来自美国德克萨斯大学奥斯汀分校的Michael Krische团队仅用13个线性步骤就完成了令人印象深刻的收敛合成,大约是之前记录长度的一半。通过战略性地使用他的团队的基于铱的转移氢化偶联反应,Krische设定了一个严格的基准,我认为这个基准可能会持续一段时间。然而,Leighton小组的第二次尝试巧妙地结合了他们自己的crotylation方法和一些战术氢甲酰化,建立在Krishe和哈佛大学的David Evans的先例上,仅用9个线性步骤就达到了目标!
该团队对四氢吡喃片段的处理方法非常巧妙(图2)。首先,铑介导的不对称氢甲酰化将醛与第一个立体中心结合在一起。尽管线性副产物的形成会略微降低产率,但作为廉价原料的第一步,它很容易就足够好了。然后,这个新的立体中心以突出的非对映选择性指导了新醛的底物控制的crotyylation。虽然crotylations是聚酮天然产物合成的支柱,也是Leighton小组的最爱,但很少看到它们在如此简单的试剂下工作得如此好,而且没有催化剂来帮助提高选择性。第二次氢生成完成吡喃环,异位羟基作为乙酸被激活。最后,加入一种西明斯型噻唑烷硫酮的烯酸钛-然后对手性助剂进行甲醇分解-在短时间内安装同名甲酯。
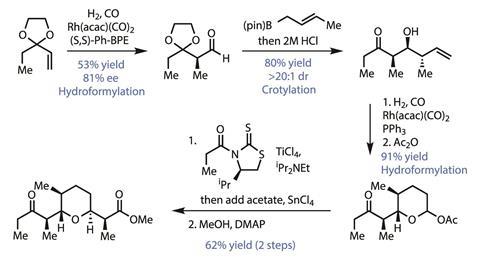
虽然它是大宗化工行业的宠儿,当然不是一个新的反应,但在全合成中很少看到氢甲酰化的显著特征。每次添加一个碳似乎是一种缓慢的组装大分子的方法,因为每一步都很重要,但该团队在整个合成过程中多次使用了这种方法。
另一半分子的合成更多地借鉴了Leighton小组自己的crotylation方法,以及他们之前在锌磷方面的经验。然而,在该小组的第一次全合成中,将分子的两半结合在一起的晚期Julia-Kocienski烯烃对新路线来说太慢且太笨拙。相反,研究人员选择了一种大胆的醛醇偶联反应,同时将两个片段结合在一起,同时建立两个进一步的立体中心。只需9个步骤,从廉价的起始材料中获得10%的产量,这是一个非常令人印象深刻的合成化学!
参考文献
1.陈丽安,阿什利和雷顿,j。化学。Soc。, 2017,139, 4568 (doi:10.1021 / jacs.7b01590)
2.Z A凯旋等,j。化学。Soc。, 2015,137, 8900 (doi:10.1021 / jacs.5b05296)










暂无评论