科学家们希望他们的策略将振兴金鸡纳树皮alkaloid-mimic催化
日本的研究人员已经开发出一种实用的方法合成一种奎宁,不会自然发生。1这对映体及其衍生物作为organocatalysts可能应用。
奎宁是一个历史上重要的自然产物。在1600年代,西班牙传教士发现原住民在南美洲使用金鸡纳树树皮治疗疟疾然后介绍到欧洲。隔离在1800年代初以来,化合物已经相当大的科学兴趣和它的合成有一个广泛的历史。罗伯特·伯恩斯·伍德沃和威廉·冯·艾格斯林根报道1944年首次正式奎宁的合成22001年,吉尔伯特鹳报道第一立体选择合成自然界中发生的对映体,(-)奎宁。3
自2001年以来,各种研究小组设计了不对称合成的奎宁,最近努诺·Maulide从在奥地利维也纳大学和他的同事使用一个碳氢键活化策略。4Maulide形容奎宁是一个迷人的天然产品,目前正在经历复兴作为总目标合成。这是因为奎宁包含一个非常基本的氮原子,上面可以催化广泛的拆分反应。
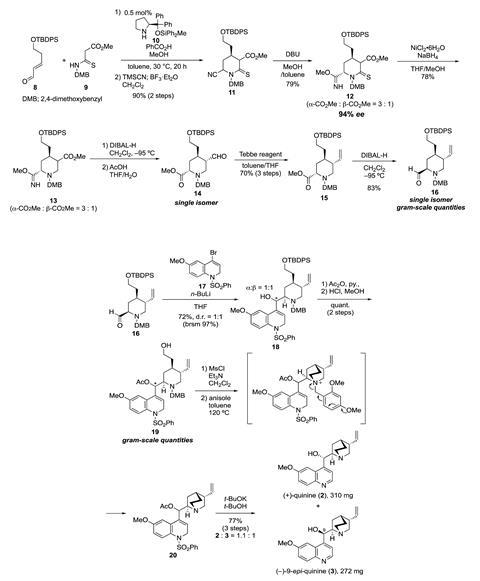
现在,一组科学家领导的Hayato石川熊本大学的合成(+)奎宁,不发生的对映体在自然界中,使用一个实际不对称方法,给出了目标化合物在15步总收率16%。Maulide描述方法为“回到罗氏公司断开,你使用一个喹啉醛亲核试剂进攻,这其实很有趣——这是一个新的承担老断开的。
石川说使用一个organocatalytic正式阿扎[3 + 3]环加成作用/ Strecker-type氰化法反应形成哌啶衍生物,organocatalyst只有0.5摩尔%,是一个特别合成的重要组成部分。合成哌啶中间时,研究人员说“很难减少含氰基的,thiocarbonyl和哌啶环酯组逐步的方式”,他们克服了通过形成一个imidate组的含氰基的功能。
下一阶段是介绍喹啉衍生物。”研究人员巧妙地采用较低氧化态耦合伙伴,dihydroquinoline,避免homodimerisation副产品同时提高反应的关键片段耦合反应。这种策略巧妙地解决了两个问题,痒访问相关的大脑在考虑战略目标分子的评论詹妮弗Stockdill发展新方法,使复杂的天然产物在美国韦恩州立大学。的最后步骤合成涉及到串联cyclisation-deprotection级联,Stockdill调用的一个美丽的解决问题的办法,避免烷基化二级或三级胺前体的自然产品,推出高度基本孤对在最后一刻”。
石川组兴奋的探索(+)奎宁的应用程序,并使用它来构建特别感兴趣轴和螺旋手性。他们正在寻求改善化合物的合成,描述了“五步总合成总收率50%(+)奎宁的”作为他们的下一个梦想。
引用
1 S Shiomi等,化学。科学。,2019,10,9433 (DOI:10.1039 / c9sc03879e)(本文是开放存取)。
2 R B伍德沃德和W E林根,j。化学。Soc。,1944,66年849、5、(DOI:10.1021 / ja01233a516)
3 G鹳等,j。化学。Soc。,2001,123年3239年,14日(DOI:10.1021 / ja004325r)
4 D H,马路等,Angew。化学。Int。。,2018,57,10737 (DOI:10.1002 / anie.201804551)









还没有评论