酶通过降低底物和产物之间的能垒来加速反应,确定这种催化能力的来源一直是科学家们感兴趣的问题。现在,中国和美国的研究人员通过观察催化原子上的电荷密度变化,解决了关于酶催化是通过过渡态稳定还是基态不稳定发生的争论。1
“酶的催化能力在很大程度上取决于非共价相互作用中发生的差异,这些差异将酶的过程与参考反应区分开,”领导这项工作的中国甘南师范大学的陈德良解释说。静电相互作用可以增加酶与底物的结合亲和力,从而稳定过渡态,降低能量势垒。相反,带电原子从周围的水环境脱溶到非极性酶活性位点可以降低酶与底物的结合亲和力,从而通过破坏基态来降低能量势垒。当考虑非共价相互作用时,过渡态稳定和基态不稳定似乎彼此不一致。
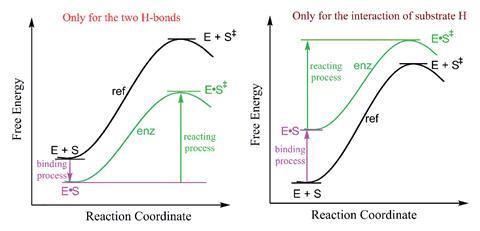
Chen和同事研究了两种酶促反应中酶和底物原子的相互作用和电荷密度:酮甾异构酶(KSI)催化的5-雄烯-3,17-二酮异构化(5-AND),酶和底物之间的静电氢键相互作用稳定了过渡态;卤代酶催化的卤化物烷基化,氯离子脱溶破坏了催化基态的稳定。他们研究了影响这些反应自由能的因素,包括酶-底物相互作用的强度以及酶和底物原子上的相对电荷密度,并在考虑与基态相比,在过渡态具有较低电荷密度的反应原子时发现了共性。
理论研究表明,由基态和过渡态之间电荷密度降低的底物原子之间的相互作用介导的所有酶催化的能量势垒都降低了,包括过渡态稳定和基态不稳定机制。通过研究导致过渡态稳定或基态不稳定的具体相互作用,揭示了这两种机制之间的差异。在KSI对5-AND的过渡态稳定异构化过程中,在酶与底物结合之前,酶的氢原子与处于过渡态的底物氧原子相互作用以降低能垒的电荷密度增强。相比之下,在基态不稳定的卤素酶催化的卤化物烷基化中,氯离子的电荷密度在酶-底物结合过程中增强,其中氯离子进行脱溶以破坏基态并降低能量势垒(ΔG‡).
对于这两种机制,研究人员已经证明ΔG‡通过增强基态下催化相关原子的电荷密度而降低(相对于它们在水中的参考反应)。这发生在酶-底物结合过渡态稳定之前和基态不稳定结合期间。Vicent Moliner领导着BioComp集团西班牙豪姆一世大学(Jaume I University)的教授指出,这些发现补充了之前的结论,即过渡态稳定和基态不稳定并不矛盾。2“这两种影响都是同一枚硬币的两面。”
参考文献
1 D陈等,化学。科学。, 2022, doi:10.1039 / d2sc01994a
2 S Martí等,化学。Soc。牧师。, 2004,33, 98 (doi:10.1039 / b301875j)










暂无评论