科学家们已经简化了利用混杂的翻译后酶制造和增强复杂分子的过程。1这项工作背后的团队表示,它可以发展成为一种平台技术,用于生成具有天然产物结构多样性的化合物库,这些化合物对自然界来说也是新的。
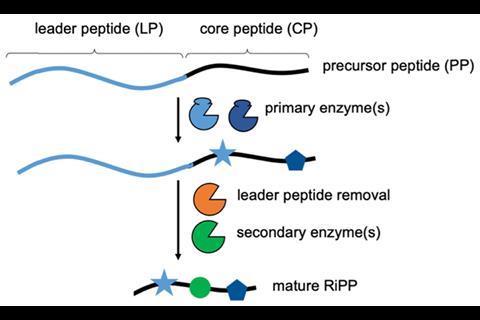
核糖体合成和翻译后修饰肽(RiPPs)是一类具有广泛结构多样性的天然产物。RiPP生物合成始于核糖体翻译结构基因以产生前体肽。然后酶在多个步骤中对其进行修饰,以产生最终的生物活性产物。“RiPP酶的工作方式非常有趣;这和酶通常的工作方式不同。酶与一个比特相结合,但在其他地方进行催化……其结果是许多这些酶高度混杂,”解释道Jesko Koehnke来自英国格拉斯哥大学。
虽然它可能被用于创建不同的化合物库,但目前,RiPP工程受限于需要定制设计的前体肽,具有翻译后酶可以结合的前体区段。在许多情况下,多肽还必须包含特定的氨基酸残基序列,以便酶将其识别为底物,然后酶将修改多肽的不同部分,即核心肽。所产生的化合物库目前是一个主题的变体,由所使用的酶的化学性质决定。Koehnke想要探索,如果消除对先导肽的依赖,是否可能有更多样化的文库。
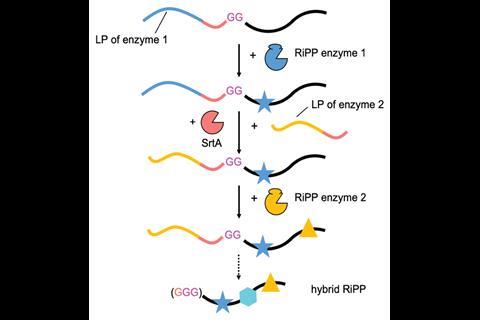
“我们尝试了不同的方法,但都没用;我们尝试用化学方法和其他酶。最后,我参加了一系列的演讲,有一个人[德克·斯瓦泽尔Koehnke回忆道:“在德国Tübingen大学,他谈到了A排序酶,然后突然之间就很容易了。”Sortase A是一种细菌酶,可以交联肽聚糖链,结构生物学家已采用这种酶将蛋白质融合在一起。德国萨尔大学的Koehnke和Laura Franz现在已经证明,sortase A可以用于在生物合成步骤之间交换前导肽,使得指示各种酶修饰核糖体产物变得更加容易。
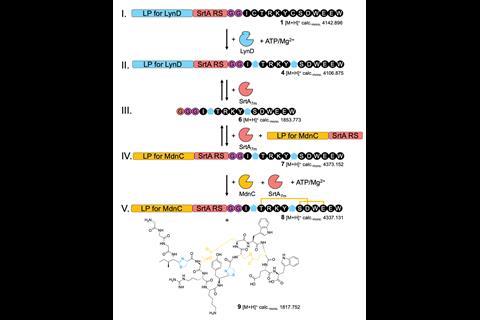
Koehnke和Franz结合了起源于不同蓝藻的两种不相关的生物合成途径的酶,作为他们的领先肽交换技术的概念证明。他们首先用LynD修饰前体肽,LynD是一种将半胱氨酸残基转化为噻唑啉杂环的酶。前体肽包含一个供LynD结合的前体片段,后面是排序酶a的识别基序,并由两个甘氨酸连接到肽的核心部分。然后,他们引入了sortase A,它在基序中的两个残基上裂解,然后在肽的这一端和前导肽之间催化一个新的酰胺键,用于下一个修饰酶MdnC。MdnC催化了某些残基侧链间酯键的形成。最后一步重新引入分选酶A,以释放所需的杂化产物。
2017年,来自伊利诺伊大学厄巴纳-香槟分校的科学家报告了一种使用具有两种不同酶识别序列的嵌合前体肽制造RiPP混合产品的方法,这样两个酶修饰步骤就可以依次发生。2这是制造混合天然产品的一大步,但用户需要知道与每种酶相关的识别序列。Koehnke和Franz的方法比较简单;他们说,它有可能发展成为一种即插即用的方法,在这种方法中,兼容的酶步骤可以产生使用传统合成化学方法不可行的复杂化合物。
“RiPP天然产品是一类非常令人兴奋的潜在药物,可以解决从抗生素耐药性到癌症等各种问题。迈克尔·朱厄特他在美国西北大学的实验室也从事核糖体合成的研究。“因此,这种方法可以构建以前无法获得的新型化合物库,以识别独特的生物治疗活性。”
参考文献
这些文章是开放获取的
1 Laura Franz和Jesko Koehnke,化学。Commun。, 2021, doi:10.1039 / d0cc06889f
2 B J伯克哈特等,ACS分科学, 2017,3., 629 (doi:10.1021 / acscentsci.7b00141)








暂无评论