2017年诺贝尔化学奖背后的科学
的2017年诺贝尔化学奖曾被授予三位科学家“开发用于溶液中生物分子高分辨率结构测定的冷冻电子显微镜”。
获奖者分别是:瑞士洛桑大学的Jacques Dubochet;Joachim Frank来自美国纽约哥伦比亚大学;以及英国剑桥医学研究委员会分子生物学实验室的理查德·亨德森。他们都为开发一种技术做出了贡献,使科学家能够看到蛋白质、核酸和其他生物分子的复杂结构,甚至研究它们在执行功能时是如何移动和变化的。
什么是低温电子显微镜?
透射电子显微镜(tem)利用电子束在原子尺度上检查分子和材料的结构。当光束穿过非常薄的样品时,它与分子相互作用,从而将样品的图像投射到探测器上(通常是电荷偶装置;CCD)。由于电子的波长比光的波长短得多,它可以揭示比超分辨率光学显微镜更精细的细节2014年诺贝尔化学奖).
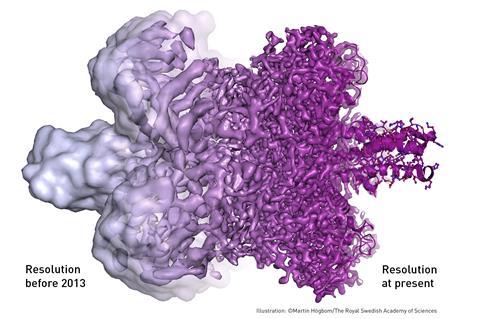
但是一些材料——尤其是生物分子——与传统tem中使用的高真空条件和强电子束不兼容。分子周围的水蒸发了,高能电子燃烧并破坏了分子。Cryo-EM使用冷冻样品、更温和的电子束和复杂的图像处理来克服这些问题。
但你不能用x射线衍射或核磁共振来观察蛋白质吗?
x射线衍射可以给出非常高分辨率的生物分子结构几次诺贝尔奖都因此而获奖。但要得到x射线结构,你需要能够使分子结晶。许多蛋白质根本不会结晶。在某些情况下,结晶过程会改变结构,所以它不能代表分子在现实生活中的样子。
Cryo-EM不需要晶体,它还使科学家能够看到生物分子在执行其功能时是如何移动和相互作用的,这在使用晶体学时要困难得多。
核磁共振还可以给出非常详细的结构,并研究小分子的构象变化或结合。但它仅限于相对较小的蛋白质或蛋白质的一部分,通常是可溶性的细胞内蛋白质,而不是那些嵌入细胞膜的蛋白质。如果你想研究更大的蛋白质,膜结合受体,或几个生物分子的复合物,低温电镜是它的所在。
获奖者做出了什么贡献?
今年的三位获奖者都解决了在透射电镜中观察生物分子的部分问题。
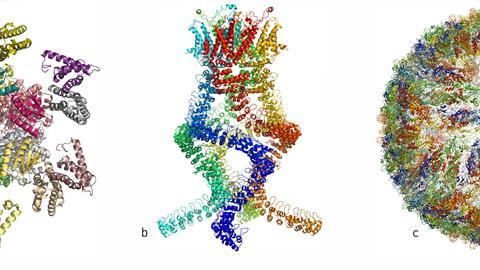
理查德·亨德森是第一个用透射电镜生成蛋白质图像的人。他将许多拷贝的紫光收集蛋白细菌紫质装入一个样品中,并使用低功率电子束从多个角度组合图像,生成蛋白质的3D图像。几十年来,他不断改进这些技术,直到他能产生与x射线衍射相同分辨率的图像。
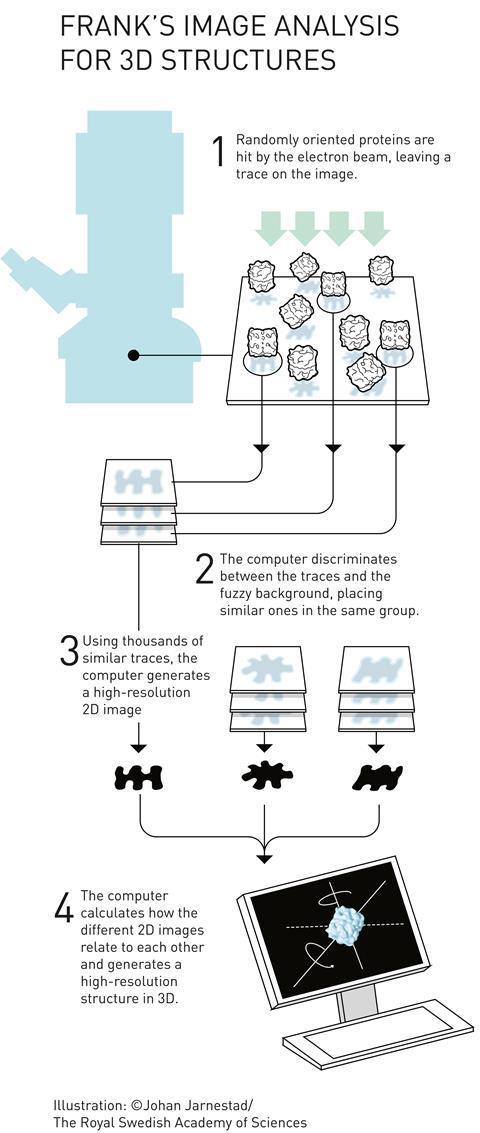
约阿希姆·弗兰克对该领域的主要贡献是处理和分析低温电镜图像。他开发了计算方法,在一个样本中拍摄多个随机定向蛋白质的图像,并将它们编译成相似方向的集合,以获得更清晰的2D图像。然后,他可以从这些2D投影中构建出3D图像。他用他的算法生成了核糖体的图像,核糖体是由几个蛋白质和RNA链组成的巨大结构,负责在细胞内将RNA翻译成蛋白质。
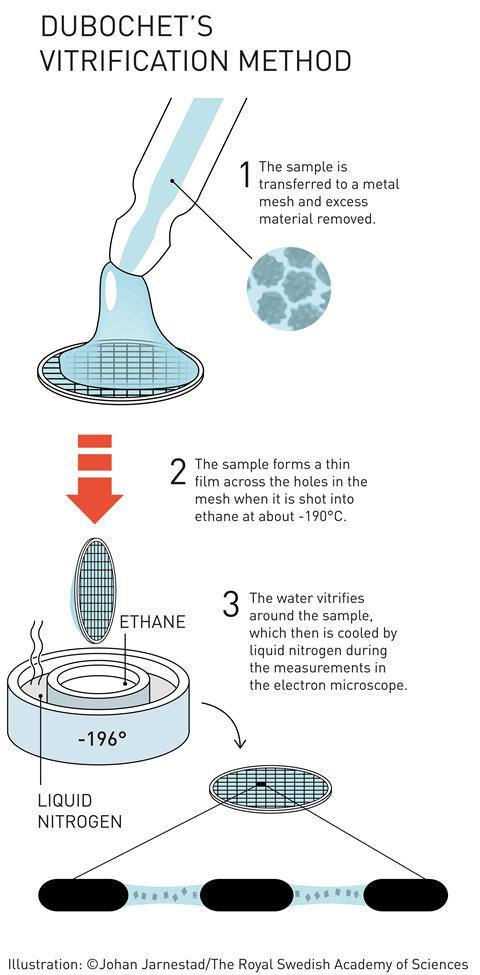
是詹姆斯·杜波切特(James Dubochet)把“冷冻”应用到低温电子显微镜中。他发明了一种快速冻结水基TEM样品的方法,使水形成无序的玻璃,而不是结晶冰。这是很重要的,因为有序的冰晶会强烈衍射显微镜的电子束,掩盖任何关于被研究分子的信息。将样品弹射到液氮冷却的乙烷浴中,TEM样品上的水薄膜会迅速冻结,以至于水分子没有时间排列成晶体晶格。在这个“玻璃化”样品中,水是无序的,但样品中生物分子的3D结构被保留了下来。杜波切特用玻璃化的水样创造了各种病毒的第一张图像。
低温电子显微镜的用途是什么?
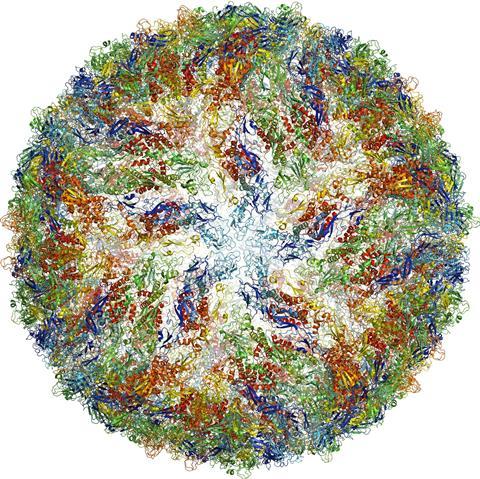
了解生物分子的功能和相互作用是生物化学的基础,是开发新药物和医学治疗以及了解和治疗疾病的基础。
最近的一个例子是寨卡病毒。在最近在巴西爆发的疫情中,一组研究人员在几个月内生成了病毒结构的高分辨率3D图像。这为寻找药物可以针对的可能位点以防止病毒传播提供了一个起点。
更多关于低温电镜和诺贝尔奖得主的信息可以在诺贝尔奖网站











2读者的评论