美国和欧洲的监管机构正在领导全球合作,以确保来自境外的药物是安全的
的美国食品及药物管理局已经发布了计划,以确保美国公民继续享有安全的药物,即使全球化的监管压力越来越大。FDA的全球参与报告概述了将其从国内公共卫生机构转变为全球公共卫生机构的转型。该计划包括建立地方监管机构联盟,形成一个强大的全球产品安全网。这将有助于提供更广泛的活性药物成分(API)生产监测,以满足发达国家对高质量、物有所值的药物的需求。但这些措施遭到了警告,称它们可能阻碍活性药物成分(API)行业的增长,并使发展中国家更难获得安全的药物。
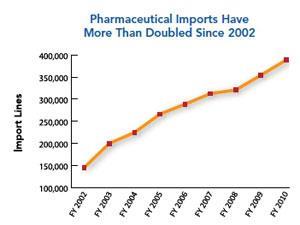
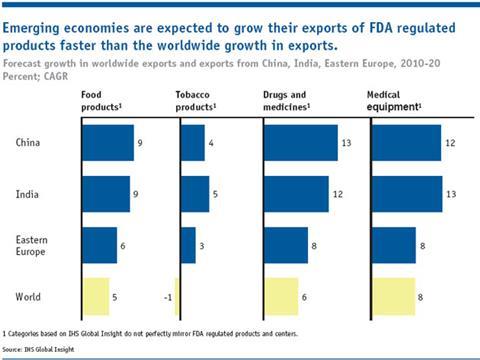
随着原料药生产向亚洲(尤其是中国和印度)的根本转移,国际监督工作已显著增加。FDA估计,从2005年到2011年,美国进口的医药产品翻了一番。该公司还预测,2012年印度和中国本土医药产值将是2006年的2.5倍。在美国以外,中国已经拥有最多的fda注册药品生产企业,其次是印度。印度医药联盟秘书长Dilip Shah告诉《化学世界》:“印度已经成为乙胺丁醇、雷尼替丁和磺胺类药物等几种药物的最大生产国。”manbetx手机客户端3.0“它不仅为仿制药行业生产原料药和中间体,也为已有十多年专利保护的品牌产品生产。”
虽然这些国家提供低成本产品,但FDA等西方药品监管机构热衷于确保这不会以不符合API良好生产规范(GMP)为代价。FDA发言人Sarah Clark-Lynn解释说:“全球的原料药都是使用ICH Q7的统一标准进行监管的。”“然而,一些国家将原料药视为另一种工业化学品。即使在承认ICH Q7的国家,在是否或如何检查原料药现场方面也存在显著差异,这可能导致在国际运输和使用原料药的监管方面出现问题。原料药的质量在一定程度上决定了消费者所依赖的最终药物的安全性和有效性。与其他组件一样,全球制造业和监管界需要保持警惕。
目前,要进入美国或欧盟市场,外国制造商的设施必须首先分别经过FDA或EMA的检查和批准。EMA生产和质量合规主管戴维•考克伯恩(David Cockburn)表示,随着药品生产转向亚洲,监管机构的任务也在增加。他说,无论是原料药还是成品,欧盟监管机构在时间和准入方面都更难对地理位置遥远的生产活动进行监管,其程度与对国内生产活动的监管程度相同。因此,更加强调进口商履行义务,并在不同程度上强调当地监管控制以及与其他国际监管伙伴的合作。最终目标必须是让地方当局能够按照国际公认的标准监督当地的活动。”
建筑法规
美国佛罗里达州立大学国际法和制药政策与监管专家Frederick Abbott指出,普遍值得信赖的地方法规还很遥远。他说,目前的问题是,印度和中国历来没有在国内监管能力方面投入大量资金,目前需要集中精力改善这一领域。在这方面,EMA和FDA首先需要与印度和中国政府合作,提高国内监管能力。只有这样,真正的合作关系才能在相互依赖的意义上实现。毫无疑问,印度和中国都有足够多的学生毕业,他们具备运营所需的技术专长。这是一个投入资源建立国内机构的问题。
检查的负担目前仍然落在发达国家,FDA正在迎接这一挑战。Clark-Lynn解释说:“FDA正在增加对国外生产基地的检查,并与全球组织合作,如药品检查合作计划,制定严格的原料药基地检查标准。”为了提高全球药品质量,我们在印度和中国等10个国家设立了13个驻外办事处。但她说,即使有了这些资源,与其他国家合作仍是该机构计划的重要组成部分。FDA不可能时时刻刻都在任何地方,我们依靠来源国健全的监管体系来检查原料药产地。
Cockburn和Clark-Lynn都强调,无论在欧洲和美国市场上生产药品的工厂位于哪里,它都已经分别受到EMA和FDA的监管。然而,地区间的团队合作可以使检查更加定期,并提供有关在一个地区受到监管、但在另一个地区尚未获得批准的设施的知识。因此,FDA和EMA近年来一直在合作,共享工厂检查报告,并寻求更好地了解彼此的检查实践。考克伯恩说:“随着这一领域的国际合作日益加强,我认为,多个地区都感兴趣的遗址所占的比例可能比人们通常认为的要高得多。”
有害的副作用
沙阿说,FDA已经在印度监管200多家工厂。他补充说,它对文件追踪的检查制度和对不合规行为的严厉惩罚是对不合规行为的主要威慑。但监管成本被转嫁到患者身上,削弱了发达国家从亚洲制造业获得的储蓄。这种影响将对小批量和低价值药品影响最大,将使小公司难以竞争。
考克伯恩说,不恰当的强调可能被放在合规成本上。他指出,与质量保证和风险管理原则相关的GMP合规是为了保护公众健康。“然而,这也促进了良好的商业行为,通过第一时间把事情做好,减少质量的可变性,从而提高效率,维护商业声誉。”
然而,雅培强调,不符合gmp的公司处于有利地位,可以从符合gmp的公司那里获得业务。他说,建厂和雇佣维持高监管标准所需的人员成本都很高。他说,印度主要的原料药生产商承诺在质量上进行投资,这些公司似乎有能力消化这些费用并在全球市场上竞争。然而,中国原料药生产商似乎在压低印度的价格。
Shah还建议,虽然遵守质量和GMP标准在技术上是可以实现的,但一些发达国家的法规实际上是对原料药进口的“非关税壁垒”。他以欧盟2011年6月的《伪造药品指令》和FDA向药品生产商收取“使用者费用”以加快审批程序为例。Shah说,如果发达国家想要降低医疗支出,就应该利用其合作来简化监管监测过程。他说,这将鼓励而不是阻止新参与者进入,从而促进竞争力量降低药品成本。
与此同时,雅培指出,大多数国家都没有像EMA和FDA这样的机构来执行海外标准。他说:“由于这种国际监管结构的分歧,外部监管能力较弱的国家的处方师——以及患者——面临更大的风险。”从我与发展中国家的配方师和原料药生产商的讨论来看,这是一个重大问题。
安迪Extance









暂无评论