调节基因触发laminin-α1蛋白生产、恢复四肢瘫痪
加拿大和瑞典的研究人员使用一种新型Crispr系统反向伤害引起的肌肉萎缩症——通常被认为是永久的——老鼠。临床前研究通常对待动物早期,症状被发现之前,说罗纳德•科恩资深科学家,总裁兼首席执行官多伦多儿童医院。
现在我们的研究结果表明,治疗窗口可能的确是广泛的,”科恩说manbetx手机客户端3.0。这一点意义重大,因为所有患者目前诊断时症状已经呈现“,他补充道。研究人员目前正在探索与产业合作努力将临床试验研究。
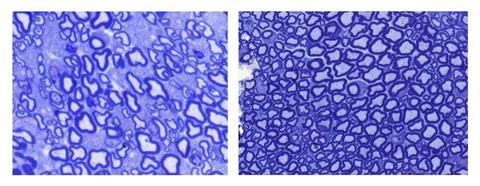
有许多形式的肌肉萎缩症,导致每个基因的突变,告诉身体肌肉蛋白有着重要的指导意义。MDC1A这种治疗目标版本,版本的蛋白质laminin-α2产生不正常工作。MDC1A影响一个孩子在30000年左右,经常导致肌肉无力从出生就意味着许多患者不能走路。在青春期后,他们可能会危及生命的呼吸问题。
一个基因来帮助他们
目前治疗MDC1A只能减缓疾病的发展过程。研究人员寻找更好的治疗方法往往目标突变问题。然而,这带来了现实的挑战,有许多可能的突变,所以小病人组与每个突变每个需要量身定制的治疗。
玛德琳Durbeej从瑞典隆德大学一直在研究一种不同的方式来处理laminin-α2的损失。她的方法利用这一事实MDC1A患者工作版本的基因称为LAMA1可以告诉细胞相似的蛋白质,laminin-α1。“移植”生产的蛋白质代替laminin-α2应该启用它。
Crispr最出名的方法是提供一个“卫星导航和剪刀组合”寻找一个基因序列和削减。移植LAMA1基因涉及削弱剪刀,变异Crispr-associated蛋白9 (Cas9)所以这种酶不能削减。科恩,Durbeej和他的同事们也把他们nuclease-deficient Cas9 (dCas9)四份蛋白VP16可以上调laminin-α1生产。
小而隐秘的
研究人员也在细胞壁边境走私这些蛋白质在他们Crispr-dCas9卫星导航可以访问他们的基因的目标。腺相关病毒载体(AAV)已经成为常规选择这样的走私,包括基因疗法,他们不会引发免疫系统不良反应。然而,他们有一个重要的缺点:他们只能承受相对较小的货物。科恩和Durbeej的团队因此转向Cas9从金黄色葡萄球菌,这比通常的Cas9小得多,研究人员使用,调用系统相结合SadCas9。
科学家们测试了他们的AAV-borneSadCas9 MDC1A老鼠出生时无法移动自己的后腿。三周后三个老鼠的人员给四组不同的治疗剂量和形式。通过七周的老鼠给最高剂量的形式包括RNA分子指导SadCas9目标可以移动他们的后腿。我们证明CRISPR可以充分上调疾病修饰基因mutation-independent方法正确与MDC1A小鼠的表型,”科恩告诉manbetx手机客户端3.0。
凯特爱德考克研究和创新主任肌肉萎缩症,英国称这项研究令人兴奋的研究,这将给希望MDC1A患者和他们的家庭。”仍有一段路要走之前带到诊所治疗,”她补充道。下一步将复制其他动物模型的研究之前,我们将研究扩展到人类。”
马库斯Ruegg瑞士巴塞尔大学的生物,这项研究指出,复制早期的发现,laminin-α1能扭转MDC1A的影响。然而,随着Lama1为基因治疗的太大了吗SadCas9方法是需要产生一个治疗,他补充道。然而Ruegg警告,被此类小说的前景的想法。“这真的是一个很好的概念验证研究而不是更多,”说。
引用
D U Kemaladewiet al,自然,2019年,DOI: 10.1038 / s41586 - 019 - 1430 - x










还没有评论