锂空气电池有望为汽车提供足够大的功率密度,但近年来其进展是否停滞了?菲利普·鲍尔报道
锂空气电池有望为汽车提供足够大的功率密度,但近年来其进展是否停滞了?菲利普·鲍尔报道

你知道这种感觉:当你需要打一个重要的电话时,你的手机电池没电了。但现在想象一下,你在一个潮湿的夜晚开车穿过一个偏僻的地方,你还有300英里的路要走,而你的手机上却闪烁着“电量不足”的警示牌,而是在你的电动汽车的仪表盘上。
随着燃料成本飙升,污染和全球变暖加剧,原则上很多人喜欢电动汽车。但在实际操作中,他们被“航程焦虑”(range anxiety)吓住了:害怕在没有电的情况下被困住。一辆家用汽车加满油可以行驶400英里,但今天的电动汽车很少能达到这个目标的四分之一,而且充电需要几个小时。所以它们在长途旅行中是毫无希望的。
IBM目前,该公司的业务已从信息技术转向能源技术,希望用它来解决电动汽车续航里程的问题电池500项目。该公司于2009年成立,旨在开发一种电池,充一次电可以为汽车行驶500英里。和许多其他电池研究人员一样,该公司对一种电池充满信心,这种电池可以将能量容量提高到现有电池的10倍以上。这种电池靠空气运行——更确切地说,是靠氧和锂的能量反应。由于锂的低密度,理论上它的氧化可以提供比目前常用的电动汽车电池(主要是镍氢电池和锂离子电池)高得多的能量密度(每公斤释放的能量),与汽油相当。1
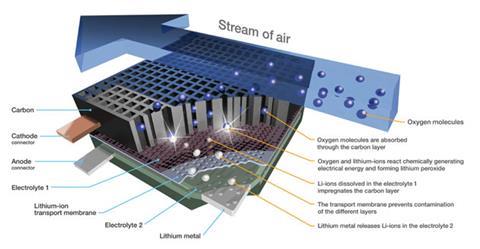
但要使锂空气电池成为一种实用的汽车技术,困难重重。2它们必须便宜、安全、可充电,并且能够承受多次充放电循环。“安全性、续航里程和成本是限制电动汽车发展的关键因素,”电池500项目经理说。“证明IBM位于加州圣何塞的阿尔马登研究实验室是该计划的基地。
尽管锂-空气电池原型已经开发出来,但还没有人完全确定电极上的电化学过程是什么,而且电解质和电极之间的界面显然很复杂,很难控制,这一事实使挑战变得复杂。威尔克说:“我们需要精确地了解细胞内发生的化学反应,这样才能用合适的材料来设计细胞。”事实证明这很棘手。
空中力量
锂空气电池在20世纪70年代首次被提出用于电动汽车,但直到1996年才开始认真研究。这是亚伯拉罕库兹卡拉尔研发公司的情况启德实验室马萨诸塞州诺伍德的一名研究人员报告了一种非水可充电装置,该装置具有锂金属阳极、多孔碳阴极和聚合物凝胶电解质。3.
制造又薄又结实的薄膜是一项挑战
在阳极,锂原子失去一个电子,形成离子,进入含有溶解的锂盐的电解质。在阴极,空气——或者在这种情况下,以及迄今为止制造的大多数其他设备——纯氧扩散到由导电多孔碳制成的电极中,氧被还原,与锂离子反应形成不溶性的过氧化锂,Li2O2(见下面的框).当电池充电时,这种化合物沉积在碳表面,随着锂离子和氧气的释放而溶解。在接下来的15年里,这些被认为是关键的电极反应。最近,事情变得很清楚,事情并没有那么简单。
亚伯拉罕的“非质子”电池——之所以被称为非质子电池,是因为它使用的溶剂中没有容易电离的氢离子——仍然是最有前途的设计,但它并不是唯一的。含有水电解质的锂-空气电池也被制造出来了,其优点是在阴极形成的产品是一种可溶性的锂化合物(通常是氢氧化锂),可以避免堵塞界面(见下面的框).但在这种情况下,锂阳极必须涂上一层阻挡层,允许锂离子通过,同时保护金属不与水发生反应。此外,到目前为止还不可能使水反应可逆:这将是一次性电池,对车辆没有用处。这就是为什么目前大多数焦点都集中在非质子细胞上。
材料的差异
在某些方面,非质子锂空气电池与第一代锂离子电池非常相似,在放电过程中锂阳极也转化为锂离子。然后,这些材料被非水电解质(如碳酸丙烯酯)运送到由锂嵌入材料(如锰氧化物锂)制成的阴极上。不同之处在于空气电池中的阴极反应能量更大,用相当相似的材料产生更高的能量密度。但这些早期的锂电池因为容易起火而臭名昭著;阳极易腐蚀,易与电解液发生反应。在充电过程中,锂金属不一定会重新沉积在光滑的涂层中,而是会生长成树枝状的手指,这最终会导致设备短路。
锂-空气电池也面临同样的问题。锂阳极与溶剂反应,也可能与锂盐的复杂有机阴离子反应,形成一系列化合物,涂层和“钝化”表面,防止进一步反应,并创建一个稳定的界面。它们能起作用,但目前还不太清楚原因——产生的表面不均匀,易碎,化学成分多样。
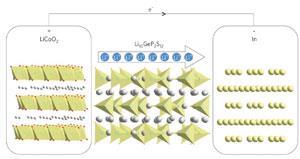
实现对阳极表面更好控制的一种方法是在锂表面涂上一层可以传输锂离子的保护层,比如所谓的锂超离子陶瓷。去年,丰田汽车的研究人员与东京工业大学的科学家合作开发了一种名为Li的材料10《全球经济展望》2年代12它具有非常高的锂离子导电性,并证明了它在锂离子电池中的用途。4不幸的是,这些陶瓷本身可能容易与锂发生反应。因此,必须在电极和较厚的超离子导体之间插入一层更稳定的锂化合物(如氮化锂或磷化锂)的进一步保护薄膜。这就造成了相当复杂的界面和制造过程。“这些保护层的导电性通常很低,制造薄而坚固的膜是一项挑战,”该中心的工程师杰克·克里斯滕森说博世研究与技术中心在加州帕洛阿尔托。
阴极方面也有很多值得担心的地方。在这里,锂离子可以与氧气发生还原反应,形成各种各样的产物,这取决于条件-它很可能,例如,锂超氧化物,LiO2,也可能和过氧化物一样形成。这些不溶性化合物的积累可以抑制反应物流向电极表面,在那里它们可以获取电子——不仅通过在多孔碳表面上形成绝缘涂层,而且通过堵塞孔隙本身并减少可达表面积。这些问题被认为是电池充电时需要比放电时更高电压的原因之一。
潜在的问题
大约五年前,人们发现在阴极表面放置催化剂,如金属纳米颗粒或氧化物,如氧化锰,可以降低这种所谓的过电位。人们认为这些催化剂的作用之一是加速分子氧在电极表面的还原速率。但这种所谓的催化作用似乎是在转移注意力。
克里斯滕森说:“那些显示使用金和铂等催化剂的细胞过电位下降的论文错误地得出结论,认为所期望的放电-充电反应正在发生。”“然而,事实证明,这些催化剂只是更有效地分解了电解质。IBM团队已经非常明确地表明,电催化在非质子锂-空气电池中完全没有作用。”
虽然彼得·布鲁斯苏格兰圣安德鲁斯大学(University of St Andrews)的霍金(david david)同意,在早期的研究中,催化剂主要只是溶剂分解的媒介,但他认为,现在就排除它们可能发挥更有用的作用还为时过早。他说:“我们现在只有获得足够稳定的电解质和电极来探索这个问题。”
不管有没有催化剂,电解液的降解都是一个严重的问题。2009年底,日本Susono的丰田电池研究部门的一个团队发现,他们使用碳酸丙烯酯电解质的锂-空气电池在阴极上根本不会产生锂氧化物。5研究人员认为锂离子与电解质发生了反应。
去年,布鲁斯和同事们证明了这些反应会产生一系列不同的碳酸锂化合物,以及二氧化碳。6今年早些时候,IBM的Alessandro Curioni和Teodoro Laino苏黎世研究实验室澄清了这是如何发生的。他们对Li反应性的从头算分子动力学模拟2O2和碳酸丙烯酯表明,过氧化物在固体状态下比作为溶液相的单一单位反应更活跃,将碳酸盐溶剂分解为碳酸烷基酯
一种会吃掉自己的电池显然用不了多久——这些设备将需要更多的抗氧化电解质。“一旦你知道了这种不稳定性背后的化学类型,筛选新的溶剂就相对容易了,”Curioni说。这就是我们现在正在做的。“然而,尽管已经尝试过其他溶剂,如二甲氧基乙烷和醚,但没有一种溶剂显示出完全的可逆性——也就是说,没有副作用,因此电池可以在充电过程中恢复到与开始时相同的状态。”威尔克说:“我们仍然会出现不必要的副反应,我们的主要目标是通过进一步改善电解质来消除这些副作用。”
一些研究人员认为,离子液体——在室温下呈液态的盐,通常含有较大的有机离子——可能会提供答案。虽然目前已知的那些也倾向于在大电化学电位下降解,但有几个小组正在努力使它们更坚固。溶剂降解的问题也可以通过仔细选择正极材料来减轻。
虽然迄今为止探索的大多数电池都使用多孔碳,但布鲁斯和同事们最近发现,使用纳米多孔金阴极可以避免二甲基亚砜溶剂的分解。8结果表明,在促进锂的氧化方面,金比碳更有效2O2在充电过程中,虽然还不清楚为什么会这样——比如说,这是否是一种催化形式。金电极既重又贵,但涂金的多孔碳也很好用。谈到成本,布鲁斯指出,“每部手机都有大量的黄金。然而,第一选择是找到低成本的替代品。”
我们的主要目标是通过改善电解质来消除不必要的副反应
到目前为止,几乎所有的原型设备都使用纯氧而不是空气,以避免与水蒸气、二氧化碳和氮气发生不必要的副反应。对于任何实用的设备,首先需要提取氧气,或者至少是富集氧气。事实上,电池可以用车载氧气罐携带的纯氧来运行,但这为经济、基础设施、安全性和车辆重量带来了一系列新的限制。威尔克认为,任何实用的车辆设备都必须使用空气,而不是纯氧,尽管克里斯滕森不排除后者。
水蒸气是一个特别的问题:它总是比氧气更容易穿过膜,部分原因是水蒸气分子更小,当然它对锂有很强的腐蚀性。即使是疏水离子液体溶剂也不能完全排除水。Aishui余上海复旦大学的教授及其同事将疏水离子液体与疏水聚合物(聚偏氟乙烯和聚六氟丙烯的共聚物)和疏水(烷基包覆)二氧化硅的细颗粒混合,研制出了一种更牢固的密封件。这种复合材料允许氧气渗透,同时排除水蒸气,因此该设备可以在环境空气中工作,而金属阳极不会受到水的攻击。10
时间的考验
即使所有这些挑战都能解决,锂-空气电池也必须能可靠地多次充电。目前的原型通常在几十个充放电循环后表现出明显较差的性能。可循环性的要求并不像乍一看那么高,因为续航500英里的电池只需要充电300次左右就能达到15万英里的可观寿命里程。尽管如此,如果电池对水分高度敏感,那么它在真正的汽车中使用的时间不会太长。
一些新的电动汽车现在使用锂离子电池:比你笔记本电脑或手机里的锂离子电池更大的版本。然而,锂离子电池花了大约30年的时间才达到这一阶段,而锂空气电池在准备投入使用之前可能需要类似的紧张研究。威尔克说:“如果一切顺利,我们可能会在2025年左右将电池用于汽车。”
这需要大量的投资。克里斯滕森说:“能源储存的资金水平不足以应对必须克服的挑战。”“我们需要便宜得多的电池才能让电动汽车得到广泛采用,而传统的锂离子电池很难做到这一点。”“锂空气电池看起来确实是最好的选择,但这将是一段漫长的旅程。
菲利普·鲍尔是一位生活在英国伦敦的科普作家
锂空气电池的电化学
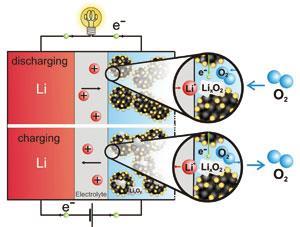
对于非质子电池(使用有机溶剂),金属锂在阳极被氧化:
李?李++ e- - - - - -
在阴极,离子在还原过程中与氧分子结合:
2李++ O2+ 2 e- - - - - -?李2O2(年代)
至少理论上是这样。但实际上,锂离子和氧的反应有几种可能的产物,特别是在有微量水存在或溶剂不够稳定的情况下。过氧化氢可以继续和溶剂反应。
锂-空气电池也可以使用水溶液溶剂,在这种情况下,阴极放电反应为:
2李++½O2+ H2O + 2e- - - - - -?2 lioh
与非质子反应相反,这种反应要求O-O键断裂,因此,阴极上的催化剂,如铂,似乎是真正有效的。
参考文献
1 G吉里什库马尔等,J.物理。化学。列托语, 2010,1, 2193 (doi:10.1021 / jz1005384)
2 J·克里斯滕森J.电化学。Soc, 2012,159, r1 (doi:jes 10.1149/2.086202)
3 K M Abraham和Z Jiang,j . Electrochem。Soc, 1996,143, 1 (doi:10.1149/1.1836378)
4 N卡玛亚等等,纳特。脱线, 2011,10, 682 (doi:10.1038 / nmat3066)
5楼美津野等,电化学, 2010,78, 403年
S·弗朗伯格等,J. Am。化学。Soc, 2011,133, 8040 (doi:10.1021 / ja2021747)
7 T莱诺和A Curioni,化学, 2012,18, 3510 (doi:10.1002 / chem.201103057)
8彭Z等,科学, 2012,337, 563 (doi:10.1126 / science.1223985)
9久保木TJ. Power Sources, 2005,146, 766 (doi:10.1016 / j.jpowsour.2005.03.082)
10张DJ. Power Sources, 2010,195, 1202 (doi:10.1016 / j.jpowsour.2009.08.063)










暂无评论