安迪·埃文斯(Andy exance)发现,长期以来反对与生物靶标发生化学反应的规则正在为新的抗癌药物提供动力
从19世纪末被发现到20世纪70年代,不起眼的阿司匹林一直隐藏着一个会让药物化学家感到不安的秘密。它的活性成分乙酰水杨酸不仅能与环加氧酶COX-1和COX-2结合,并阻止它们制造炎症背后的前列腺素分子——它还能以共价和永久的方式与它们结合。长期以来,这种不可逆性一直让药物开发人员感到焦虑,部分原因是另一种药物柜里的坚定支持者——扑热息痛。我们的身体代谢扑热息痛,也被称为对乙酰氨基酚,以产生一种与肝脏蛋白质共价结合的高活性中间体。这与毒性有关,对类似问题的恐惧推动了药物研发的正统,即避免永久性附着的药物。
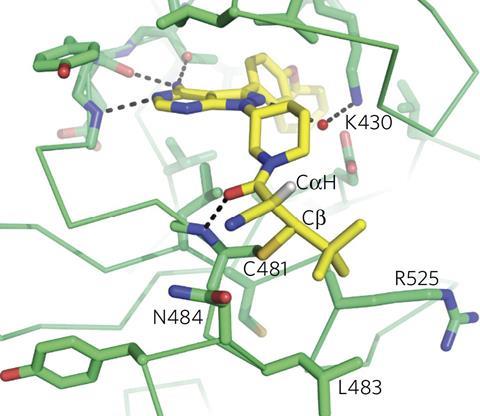
如今,这种正统观念已经破灭。最近的几项研究表明,尽管存在对共价药物的偏见,但仍有许多共价药物。例如,一项分析71种酶的研究发现,约四分之一的酶被批准的药物共价抑制。12011年,研究人员估计,有数据可查的26种共价药物的全球年销售额超过330亿美元(264亿英镑)。2因此,药物开发人员已经意识到共价结合不仅仅是允许的——在某些情况下,它实际上是可取的。美国印第安纳波利斯礼来公司的药物化学家雷纳托·鲍尔承认:“我们现在只是试图理性地设计它们,而不是局限于偶然发现它们。”
在过去的五年里,这些努力已经取得了回报,有五种共价结合的抗癌药物上市了。然而,像鲍尔这样的科学家还有很多工作要做,包括将方法引入那些不能容忍脱靶效应的疾病,比如那些最初引起警报的疾病。
锁卡住
如果酶是锁,与它们结合的分子是钥匙,共价抑制剂就能有效地将钥匙从锁中断开。美国旧金山Principia Biopharma公司的首席科学官David Goldstein强调说,永久性的阻碍是一种优势。这种分子可以一次性关闭酶,至少在我们的细胞重新合成它们之前,这可能需要几个小时到几天的时间。因此,患者应该少服药。
酶生命周期的持久性,以及共价附着在与酶的正常伙伴竞争时所具有的优势,也意味着药物分子可能被设计成任何多余的药物都能更快地离开身体。虽然非共价药物依赖于在不同酶家族成员中通常相似的结合位点特征,但共价附着发生在并不总是共享的反应位点澳门万博公司上。因此,共价抑制剂药物可能更具选择性。总的来说,这些优点可以最大限度地减少患者对药物的接触、药物可能引起的任何副作用,以及可能导致耐药性的相互作用。
Goldstein解释说:“Principia的创立是为了扩展这一概念,以创造出比传统的非共价方法具有更大选择性和更长的靶点接触的小分子药物。”“这种方法被设想为实现具有更大疗效和耐受性的药物。””And appropriately, the primary drug class scientists using this expectation-upending approach have focused on – kinase inhibitor cancer drugs – has itself upended expectations.
不是无法下药,而是令人不快
激酶是许多生物过程中至关重要的酶,参与处理“能量货币”分子ATP。因为人类有超过500个激酶的“kinome”,它们具有类似的药物可以结合的活性位点,所以它们曾经被认为是“不可服用的”。如果一种药物阻断了一种激酶类型来阻止癌细胞代谢,那么它很可能会阻断其他激酶类型,从而产生严重的不良影响。然而,在2001年,酪氨酸激酶抑制剂(TKI)伊马替尼(Glivec),被批准用于慢性骨髓性白血病,一种罕见的癌症。如今,为了提高市场上各种TKIs的生存机会,癌症患者已经准备好接受它们令人不愉快的副作用,包括严重腹泻。
Goldstein说:“选择性靶向少量激酶仍然是主要挑战之一。”“这个问题在胃和上胃肠道尤其严重,因为口服药物后药物浓度通常很高。”在这样的浓度下,选择性差的TKIs可以抑制胃肠道中表达的kinome的很大一部分,导致严重的、通常是剂量有限的毒性。”
Goldstein断言,相比之下,通过共价结合靶向半胱氨酸氨基酸残基使TKIs实现了“前所未有的选择性和效力”。Principia正在PRN1371中使用这种方法,PRN1371是一种靶向成纤维细胞生长因子受体的TKI,目前处于I期试验中。共价药物也被用于抑制表皮生长因子受体(EGFR)酪氨酸激酶,当它们发生突变并使癌症对非共价药物产生耐药性时。
它需要极高的精度来塑造分子,使它们只附着在一种酶的反应位点上,而避免其他酶的反应位点。为了实现这一目标,辉瑞采取了一种详细的方法来使用和研究共价抑制剂,该公司美国格罗顿工厂设计和合成科学高级总监Adam Gilbert解释说。吉尔伯特解释说:“我们决定为目标/项目寻求共价抑制剂,它们比可逆抑制剂具有明显的优势。”“我们还认为,了解共价抑制剂亲电试剂与生物学上相关的亲核试剂的反应性将使我们深入了解共价抑制剂的设计。”
辉瑞的研究包括分析共价抑制剂亲电试剂与谷胱甘肽的内在反应性3.和N-acetyl-lysine4,以模拟它们可能分别靶向的半胱氨酸和赖氨酸氨基酸亲核试剂。吉尔伯特说:“随后,我们利用这些数据为过去和现在的许多项目设计共价抑制剂,通过使用反应性最低的亲电试剂来提供我们想要的效力和选择性。”
提高共价激酶抑制剂的选择性是辉瑞最初面临的最大挑战,Gilbert补充说,它与美国圣地亚哥斯克里普斯研究所的Ben Cravatt合作。克拉瓦特被共价抑制剂所吸引,认为它是一种更严格的工具,可以用来理解小分子在生物系统中的相互作用。他解释说:“因为它们是永久附着的,所以你可以使用基于质谱的方法来检查蛋白质。”在这些清单中列出的细节是共价附件发生的确切位置。
测试弹头
例如,Cravatt的团队和辉瑞团队用共价TKIs培养癌细胞。粉碎细胞并分析其中的蛋白质片段,确定了抑制剂所附着的29个脱靶蛋白。5该研究揭示了选择性靶抑制的特定TKI“浓度窗口”,超过该窗口它们与脱靶蛋白发生反应,具有毒性作用。
Cravatt说,结果还表明,共价附件通常并不在酶抑制剂通常靶向的“锁孔”结合袋中。他说:“目前我所知道的每一种共价靶向半胱氨酸的药物实际上都是针对蛋白质外部的非催化半胱氨酸。”“它们的选择性是合理的,但大多数脱靶的不是激酶,而是含有功能性半胱氨酸残基的其他蛋白质。”
在斯克里普斯位于美国佛罗里达州的研究基地,科学家们正在探索在某些情况下共价抑制是否可能反向起作用。Kate Carroll的研究小组发现,由于EGFR中的目标半胱氨酸被氧化,一些癌细胞对勃林格殷格翰的共价TKI阿法替尼(Giotrif)产生了耐药性。团队成员Vinayak Gupta解释说,这是因为癌细胞中有大量的活性氧,它们可以将半胱氨酸转化为它的亚磺酸(Cys-SOH)。
与半胱氨酸那样的亲核试剂不同,亚磺酸是亲电试剂,这可能有助于解释其他化合物的生物活性。古普塔说:“这里的想法是,有‘亲核’化合物已经‘隐藏’在目前的天然产品中,如姜黄素和fda批准的药物,如[辉瑞的TKI] tofacitinib。”6“很有可能存在一种潜在的作用机制,由这些‘隐藏的’亲核试剂驱动,它们以Cys-SOH为生物靶标。”
因此,卡罗尔、古普塔和他们的同事们试图分析可以利用这一现象的分子。但最初,与相对广泛的亲电抑制剂相比,只有一种中等活性的亲核试剂可用于检测Cys-SOH。斯克里普斯佛罗里达研究小组因此开发了一个潜在共价抑制剂库。古普塔说:“我们现在有亲核弹头,它能以生物相关的速率与Cys-SOH发生反应,比之前标准的Cys-SOH探针快200多倍,而且是不可逆和可逆的。”7这一点尤其重要,因为科学家们正在试图了解如何对这些武器库进行分类,消除粗鲁的错误,并越来越接近众所周知的神奇子弹。
中毒了吗?
尽管共价药物具有优势,但除了在较老的药物中偶然引入共价效应外,它们很少被开发用于癌症以外的疾病。除了生死攸关的疾病之外,脱靶亲核试剂的不可逆修饰所引起的不良反应的风险被认为太大了。
吉尔伯特说,例如,高活性、低选择性的共价粘合剂“肯定会引起毒性问题”,因为它会将蛋白质分子量提高到触发免疫反应的阈值以上。因此,他和他的辉瑞同事在实验室中用放射性标记的共价药物处理人类肝细胞,以估计可能允许的“共价结合负担”极限。8吉尔伯特说:“我们发现了一些安全共价药物的例子,它们已经使用了几十年,共价结合负荷低于10毫克/天。”“虽然我们不能说10毫克/天是否是一种安全剂的神奇结合负荷极限,但我们相信结合负荷试验可以用于优化共价粘合剂,使其更安全。”
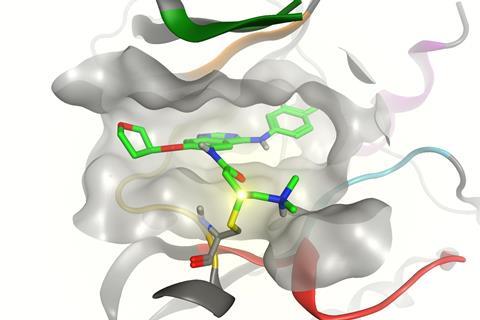
通过努力确保他们的药物有足够的选择性,各种公司现在能够将低剂量共价抑制剂投入临床试验。“这些化合物显示出良好的安全性,”吉尔伯特说。“我们不能排除或预测这些药物的特殊毒性,但到目前为止,这种精心设计的新一代共价抑制剂显示出与可逆抑制剂相似的毒性特征。”
Goldstein断言,这在对抗癌症时可能是可以接受的,但这仍然意味着开发共价抑制剂来治疗慢性非危及生命的疾病具有挑战性。因此,Principia Biopharma正在开发由其联合创始人、加州大学旧金山分校(UCSF)的Jack Taunton首创的概念。他的团队发现,像氰丙烯酰胺这样的亲电试剂可以共价地与半胱氨酸残基结合——但与其他现有药物不同的是,它们是可逆的。9
Goldstein解释说,任何与氰基丙烯酰胺等化合物脱靶结合的后果都应该是短暂的。他说:“通过可逆共价抑制,我们已经证明,当抑制剂与靶标分离时,蛋白质会恢复其功能,而不是永久地改变其结构和功能。”“因此,可逆共价结合的结果与非共价小分子药物没有什么不同。”
Principia使用这种方法来靶向布鲁顿酪氨酸激酶(BTK),这是人类免疫信号通路中的一个关键元素,涉及类风湿性关节炎等疾病。10目前,该公司正在对罕见且可能危及生命的皮肤起泡疾病寻常型天疱疮进行II期试验。Goldstein解释说:“在自身免疫性疾病中,Principia的先导分子PRN1008是一种可逆共价抑制剂,口服给药后最初可100%抑制BTK。”“尽管化合物的清除率很高,但它会慢慢脱离靶标,导致下一次剂量前大约60-80%的抑制作用。”这种药物具有高疗效、良好的耐受性和安全性。”
注定会成功?
Bauer说,对于礼来公司的药物化学家来说,他们对共价抑制剂的兴趣非常广泛——不仅涉及可逆反应的亲电试剂,还包括目前在药物发现中所知甚少的亲电试剂。礼来公司也有一种不可逆共价BTK抑制剂在类风湿关节炎的II期试验中。似乎传统的性质设计,如分子形状,可以产生足够的选择性,以避免在这种情况下脱靶结合。鲍尔解释说:“中等亲电试剂,如丙烯酰胺,是否倾向于任意烷基化,似乎更多地取决于母分子的性质,而不是亲电试剂存在的简单事实。”
像任何单独的药物一样,共价抑制剂仍然面临着很大的机会无法获得监管机构的批准。尽管如此,这种新方法可能会产生更广泛和根本性的重要影响。鲍尔解释说:“共价结合在其他发现领域也很重要,比如用化学生物学方法来了解疾病。”“在早期项目中,共价抑制剂发挥着额外的作用,比如作为工具分子来阐明扰动生物通路的影响。共价抑制是独特的,是许多传统方法的补充。”
也许共价抑制剂最大的机会是Bauer强调的另一个非激酶靶点。K-Ras(G12C)是一种突变的GTPase蛋白,参与细胞信号传递,在大约20%的肺癌中发生。然而,克拉瓦特警告说,它“一直被认为是一种很难下药的东西”。然而,通过利用活性半胱氨酸,2013年,加州大学旧金山分校的Kevan Shokat团队发现了与它结合的化合物。11这些共价抑制剂利用它们的能力附着在传统的结合口袋“锁眼”之外,在一个以前未知的位置。
克拉瓦特的团队已经在其他地方找到了模仿这种鬼鬼祟祟的开锁方法的空间。他们在一种活性极高的碘乙酰胺亲电试剂的帮助下筛选了癌细胞中的小亲电试剂,除非被另一种化合物阻断,否则它会与每一种可用的半胱氨酸发生反应。12斯克里普斯的研究人员随后将同位素标签添加到碘乙酰胺残基上,这使他们能够量化它们的相对丰度。克拉瓦特解释说:“在一个机械相关的课程中,你要评估50-100种酶。”
Cravatt解释说,他们的结果表明,正如UCSF的K-Ras(G12C)工作一样,共价抑制剂通常针对“完全不同的折叠,完全不同的功能”。他现在正在更广泛地探索这一现象,包括通过Vividion Therapeutics,该公司是他与斯克里普斯的化学家于金泉(Jin-Quan Yu)和菲尔·巴兰(Phil Baran)于2017年2月共同创立的。Cravatt透露,Vividion活性的一个重要组成部分将是共价化学驱动的。
克拉瓦特对共价抑制剂的前景感到特别兴奋,因为“近年来已经取得了多次成功”。他说:“为激酶抑制剂开发的共价化学物质,你可以有力地证明它们比可逆的激酶抑制剂有优势。”然而,他热衷于超越激酶的“非常可药物的口袋”。“问题是,我们能否在被视为不可用非共价化学药物的蛋白质上取得进展?””
安迪·Extance是一位生活在英国埃克塞特的科学作家
参考文献
1 J G罗伯逊,生物化学, 2005,44, 5561 (doi:10.1021 / bi050247e)
2 J·辛格等,Nat. Rev.药物发现, 2011,11, 307 (doi:10.1038 / nrd3410)
3米E弗拉纳根等,医学。化学。, 2014,57, 10072 (doi:10.1021 / jm501412a)
4你P达哈尔等,地中海,化学。Commun。, 2016,7, 864 (doi:10.1039 / c6md00017g)
5 B R朗宁等,Nat,化学。医学杂志。, 2014,10, 760 (doi:10.1038 / nchembio.1582)
V Gupta和K S Carroll,化学。Commun。, 2016,52, 3414 (doi:10.1039 / c6cc00228e)
V Gupta和K S Carroll,化学。科学。, 2016,7, 400 (doi:10.1039 / c5sc02569a)
8 U P达哈尔等,化学。Toxicol >,, 2013,26, 1739 (doi:10.1021 / tx400301q)
我是塞拉菲莫娃等,Nat,化学。医学杂志。, 2012,8, 471 (doi:10.1038 / NChemBio.925)
10 J M布拉德肖等,Nat,化学。医学杂志。, 2015,11, 525 (doi:10.1038 / nchembio.1817)
11 J M Ostrem等,自然, 2013,503, 548 (doi:10.1038 / nature12796)
12k M巴克斯等,自然, 2016,534, 570 (doi:10.1038 / nature18002)









暂无评论