有机化学家致力于打破通常被认为是不反应的化学键
有机合成的既定逻辑围绕官能团展开,羰基、醇和胺等原子的反应基控制着分子中的哪个键在一定条件下会断裂。合成复杂分子的艺术在于,在从简单的起始材料构建分子的过程中,能够以最有效的方式协调这些分子。
碳氢键被认为是无活性的——除非在官能团附近被激活——因此在规划合成路线时历来被忽略。但近年来,综合逻辑的范式发生了转变。“我们不是关注官能团,而是研究碳氢键本身的化学性质,原则上,即使存在被认为是活性基团的基团,我们也在做这件事,”解释说Huw戴维斯他是亚特兰大埃默里大学的有机化学教授,也是全美范围内选择性碳氢功能化中心的负责人。“这给了我们一种完全不同的分子组合方式。它通常能让你进入新的化学领域,这对新药开发、农用化学品和材料科学等领域非常有用。”
这种方法不仅可以让化学家制造出以前无法制造的分子,而且还可以缩短和简化合成路线,使之达到现有的合成路线。C-H功能化的显著优势之一是,在最终分子(如氧原子或氮原子)中添加所需的功能,而不是在其合成的最后阶段。
你如何让化学反应起作用,从而以一种实际的方式瞄准特定的碳氢键?
Huw戴维斯
“经典的有机合成侧重于构建碳氢化合物支架,同时引入氧和氮。有机化学家解释说:“通常这两者是联系在一起的,像醛醇或曼尼希反应用于构建碳氢化合物支架。克里斯蒂娜白美国伊利诺伊大学。“如果你在过程中引入氧气或氮气,你必须保护它,去保护它,操纵它的氧化状态。这导致了非常漫长的化学操作。能够(在后期添加氧或氮)通过最小化官能团操作和氧化态变化,让你真正简化了这些合成。”
C-H功能化的另一个相关优势是能够一步生成一个分子的衍生物,这也是制药工业特别感兴趣的。“大自然通常会构建一个复杂的支架,然后引入不同的氧化功能,真正有效地制造一个分子的许多不同衍生物。”传统上,有机化学家想要制造八种不同的衍生物,比如说,在新的位置上具有新功能的紫杉醇,就必须进行八种从头合成。”怀特解释道。C-H功能化技术现在已被用于一系列不同的天然产物在合成结束时的衍生化,这种技术被称为后期C-H功能化。1大自然使用酶来进行这些操作,反过来,有机化学家已经转向小分子金属催化剂,用于碳-氢功能化的所有领域。
网站选择性
使用一系列不同的金属催化剂,现在可以将C-H键转化为许多其他类型的键,包括碳-碳,碳-氧,碳-氮和碳-卤。它们能够从芳香族和脂肪族化合物的碳原子中提取氢。但也许最令人印象深刻的是,他们现在开始很好地控制分子中碳氢键的反应。
戴维斯解释说:“挑战在于,当每个分子都有很多C-H键时,如何让化学反应起作用,从而以实用的方式将特定的C-H键功能化。”有时答案是借用经典有机合成中的指导基团的概念。“使用可以与金属催化剂配合的定向基团,将金属放置在特定的C-H键附近,并允许选择性功能化发生。”
通常情况下,我们讨论的指向基和碳氢键之间只有几个原子的距离,但它们并不总是这样。在2016年,梅勒妮·桑福德美国密歇根大学的研究人员报道了一种将芳香环中的碳插入到环状脂肪胺的远端C-H键上的方法。在这里,胺的氮起着引导基团的作用。2
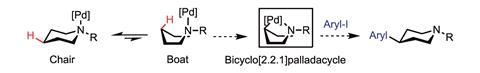
她的团队首先在环上的氮上附加了钯催化剂和配位基团。当环自然地从椅形翻转到船形时,钯插入环另一侧的C-H键,将环固定在这个不太有利的位置。在这一点上,钯与胺的氮和原来碳- h键的碳都有很强的配位。最后一步是加入芳基卤化物,形成新的C-C键并释放钯催化剂。桑福德说:“我们真的很喜欢设计一种催化系统的化学挑战,它可以让你有选择性地功能化,而不是氮。”
许多范围更广的新型手性配体也在研究中
Jin-Quan余
与此同时,Jin-Quan余美国加州斯克里普斯研究所的研究人员正在开发一种替代方法,利用底物和催化剂之间较弱的配位。Yu已经证明了他的方法在远程位点C-H功能化的实用性,但最重要的是,他已经能够合并手性配体,使C-H功能化具有对映选择性。
Yu说:“如果我们想在不对称催化的背景下开发对映选择性C-H激活反应,之前由底物强烈配合驱动的反应本质上是背景反应,可以阻止对映控制。”“因此,使用在无配体条件下不反应的弱配位底物至关重要,并确保反应性由配体加速驱动,从而实现对映选择性。”
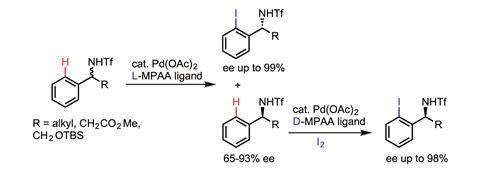
到目前为止,Yu的第一个手性配体(一种单保护氨基酸)已成功应用于开发“各种对映选择性C-H激活反应”,他补充道。3.在这些反应中,C-H键被转化为广泛的碳-碳和碳杂原子键,手性被去对称性或动力学分解放大,这取决于底物的结构。“许多用于亚甲基C-H对映选择性活化的新手性配体也正在研发中,范围更广。”
不需要协调
协调并不是控制站点选择性的唯一方法。怀特和戴维斯倾向于另一种被称为催化剂控制碳氢功能化的技术。戴维斯解释说:“这样做的好处是你不需要添加指导基团,因为控制元素将来自催化剂。”在这里,催化剂的性质被调整以控制分子中哪些C-H会发生反应。这是可能的,因为这些键都有微妙的不同的电子和空间性质,合适的催化剂能够挑选出来。
White在2007年和2013年分别报道了两种小分子铁催化剂Fe(PDP)和Fe(CF3.PDP) -可以在脂肪族分子中以立体定向和位点选择的方式形成碳-氧键,而不使用定向基团。1、4她说:“这项工作表明,可以通过改变催化剂来合理地改变反应部位。”
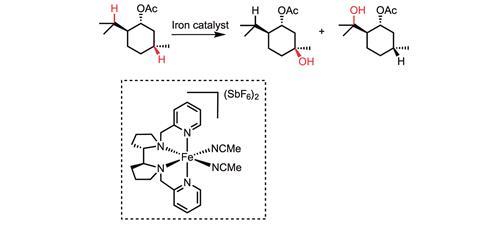
她的团队专注于通过插入活性金属结合的oxo和nitrene物种来形成碳-氧和碳-氮键。在这里,氢首先被氧基或硝基从分子中抽出来,生成一个短期的碳中心自由基。接下来,金属的Fe-OH功能化非常迅速,形成羟基化产物,甚至没有时间进行键旋转。这意味着如果你从一个手性中心开始,你的产物也是手性的。1怀特说:“机理研究表明,C-H抽象步骤和功能化步骤都受到金属中心的严格控制,这就提供了对反应活性施加如此高水平催化剂控制的能力。”
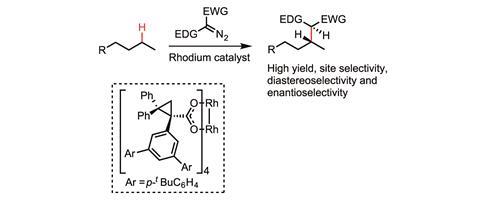
与此同时,戴维斯专注于通过在碳氢键中插入金属结合的类碳碳键来形成碳碳键。给受体碳素是他的专长。戴维斯说:“传统的碳类化合物通常只有受体基团,这使得它们难以置信地缺乏电子,因此反应非常活跃,因此没有特别的选择性。”“我们开发了这些供体-受体碳素,供体组显著稳定了碳素。我们能够以相当显著的位点选择性进行[C-H功能化]。我们也可以用高对映选择性来做,在很多情况下,我们可以产生多个立体中心所以我们也可以用很好的非对映选择性来做
2016年,戴维斯的团队开发了一种镝催化剂,能够选择性地使戊烷中第二个碳上的C-H键功能化,而不是第一个或第三个碳上的C-H键。5这很重要,因为在这个分子中碳氢键之间只有非常细微的区别。该反应具有95%以上的位点选择性和良好的立体控制性。
功能化小碳氢化合物目前很流行,Sanford在2016年报道了甲烷的C-H硼化反应。“甲烷是天然气的主要成分,有选择性地将甲烷转化为增值化学品的方法对石油和天然气行业非常有意义,”Sanford解释说。“通常情况下,如果你试图使甲烷功能化,它只会一直变成CO2你不能只把一个碳氢键功能化,因为产物比起始物质反应性更强。然而,她的团队却做到了这一点,他们使用了几种不同的金属催化剂,将硼插入甲烷的一个碳氢键中。她补充说:“我们现在的反应离应用还很远——例如,它太昂贵了——但能够控制甲烷功能化的选择性是一个真正根本性的兴趣。”
解决惯性
碳氢键并不是化学家们竭尽全力想要打破的唯一“惰性”键。例如,尼尔·加格(Neil Garg)正在研究将酰胺中的强碳氮键转化为碳碳键。他选择的工具是过渡金属催化交叉偶联反应。
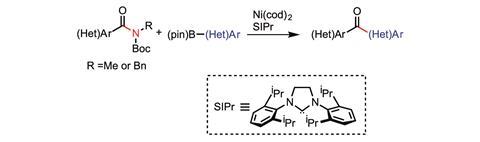
“在酰胺中,碳氮键通过共振效应显著增强。打破酰胺并不容易,因为C-N键具有大量的双键性质,”Garg解释道。利用镍催化剂,他的团队成功地将一系列不同酰胺中的C-C键转换为C-N键。这意味着它们将酰胺转化为酮。
在反应中,镍催化剂激活了酰胺的C-N键,使其与硼酯发生交叉偶联,形成C-C键。Garg的团队成功地添加了两种芳香族8和non-aromatic9碳连着碳氮键。
Garg解释说,他的团队现在已经建立了这种反应的概念证明,并且“看到了很多耐受杂环和相当立体阻碍的底物的希望”。“我们现在的目标是扩大范围,开发出能够覆盖更广泛用户群的化学物质。”
Chemoselectivity
所有这些不同的催化体系的另一个重大障碍是实现化学选择性,在这方面已经做了很多工作。这包括确保C-H键与催化剂反应,而不是分子中通常被认为反应性更强的另一种键。一些令人吃惊的例子现在已经出版。例如,在2015年,White报告了一种锰催化剂,即使存在非常活性的C=C双键,也能选择性地将氮插入脂肪族C - h键中。7这个特殊的反应被设计成在含氧官能团的三个原子之外安装一个氮。White解释说:“这需要现成的天然产品,通常含有丰富的氧气功能,并允许你制作1:3的氨基醇主题。”
近年来,C-H功能化领域在无数个不同的方向上爆发,现在已经开发出许多聪明的反应。但化学家们可能只是刚刚开始触及可以实现的东西的表面。Yu说:“C-H激活领域为发现新反应、新催化剂提供了沃土,而C-H激活的全部潜力还远远没有达到。”
尼娜Notman是一位生活在英国索尔兹伯里的科学作家
参考文献
1陈敏生和怀特敏聪,科学, 2007,318, 783 (doi:10.1126 / science.1148597)
2 J J托普瑟斯基等,自然, 2016,531, 220 (doi:10.1038 / nature16957)
3朱良,肖建杰,于建强,科学, 2014,346, 451 (doi:10.1126 / science.1258538)
4 P E戈米斯基,M C怀特,j。化学。Soc, 2013,135, 14052 (doi:10.1021 / ja407388y)
5 K廖等,自然, 2016,533, 230 (doi:10.1038 / nature17651)
6 .库克等,科学, 2016,351, 1421 (doi:10.1126 / science.aad9289)
7 S M Paradine等,Nat. Chem, 2015,7, 987 (doi:10.1038 / nchem.2366)
8 A韦尔斯,L贝克和N K加格,Nat。化学, 2016,8, 75 (doi:10.1038 / nchem.2388)
9 B J西蒙斯,ACS Catal.2016年,6, 3176 (doi:10.1021 / acscatal.6b00793)










暂无评论