当它是核酶时。Clare Sansom报道。

小学生物化学课程教给学生的首要原理之一是,酶是蛋白质。酶是一种催化剂,可以将生命系统中的化学反应加速数百万倍。对于绝大多数酶来说,这当然是正确的,但这是一种简化——就像分子生物学的中心法则(DNA制造RNA制造蛋白质)的传统陈述是一种简化。1982年,人们惊奇地发现,仅RNA分子就能具有催化活性,这第一次证明了核酸不仅仅是被动的信息载体。我们现在知道RNA催化对生命至关重要;我们了解了许多这种“核酶”的化学机制,并开始重新设计和设计它们,最初主要是作为研究工具,但着眼于作为开关和生物传感器的应用,最终作为治疗手段。
核酶的发现彻底证明了RNA是细胞生命的核心参与者
美国科罗拉多大学的托马斯·切赫是第一个发现具有酶活性的RNA分子的人。20世纪70年代末,他刚刚在科罗拉多建立了自己的实验室,研究一种生活在池塘里的原生动物的核酸处理和基因表达四膜虫thermophila.他注意到,当在试管中分离时,来自这种鲜为人知的生物的RNA分子可以被切割成碎片或拼接。“我们浪费了一年时间寻找参与这种剪接反应的蛋白质。他说:“因为它是如此之快和特异性,它必须由酶催化,当然我们知道‘所有的酶都是蛋白质’。”“我们花了很长时间才意识到,没有蛋白质,RNA本身就是催化剂。他开始通过将相同的RNA分子表达到细胞中来证明这个“异端”大肠杆菌并表明没有污染四膜虫蛋白质可能是造成这种反应的原因。
切赫还创造了“核酶”这个名字,当时他在实验室组织了一场比赛,为他们发现的分子命名。“我们对这个名字提出了一些建议四膜虫.我选择了更普遍的“核糖酶”,但我是在冒险,因为我们的仍然是唯一已知的例子。他解释说:“如果它是唯一的例子,或者可能只在原生动物中发现,我们会显得相当愚蠢。”当然,这些担忧最终被证明是毫无根据的:第二种催化RNA是在美国耶鲁大学的西德尼·奥特曼(Sidney Altman)的证明中发现的,在细菌中发现的RNA -蛋白质复合体的催化部分RNase P实际上就是核酸时发现的。
切赫和奥特曼因这些发现共同获得了1989年诺贝尔化学奖,我们现在知道核酶参与了许多不同的生化过程:主要但不限于RNA加工。切赫说:“核酶的发现彻底证明了RNA是细胞生命的核心参与者,并引发了人们对RNA的兴趣,并获得了更多的诺贝尔奖。”
拿个锤子敲一下
所谓的“锤头”核酶——得名于其结构的早期二维图与鲨鱼之间的相似之处——催化RNA分子的特定位点切割。它们于20世纪80年代中期首次在被称为类病毒的微小病毒样植物病原体中被观察到,但现在已知它们存在于自然界中,包括人类体内。这些相当小的rna的结构和它们催化的简单反应的化学性质现在已经非常清楚了。严格地说,它们的自然功能根本不是“催化”:目标RNA序列被磷酸二酯键的异构化分裂,核酶本身被反应消耗。人们最初认为这种反应需要一种二价金属离子,就像金属蛋白酶需要锌一样,但现在认为这些离子主要参与稳定RNA支架。
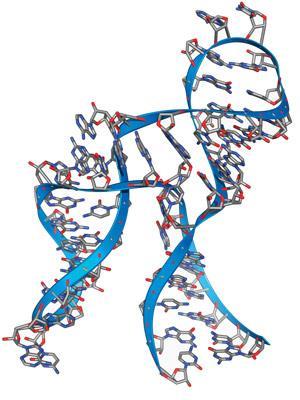
锤头核酶本质上是顺式作用的:也就是说,它们的自然活性是裂解,从而使自己失活。由于它们是相当小而简单的分子,因此相对容易设计它们来切割外部底物(反式代理)。此外,锤头核酶由一个保守的中央催化核心组成,具有两条“臂”,可以识别要被切割的RNA序列,因此设计一个核酶通过改变臂中的核苷酸来切割特定序列是相当简单的。
一些研究小组正在利用这种技术设计核酶来识别和切割特定的RNA序列,以帮助阐明体内的分子机制和生物技术应用。日本福冈大学的Matasora Fukuda和他的团队正在使用它来了解RNA编辑的一些机制。这个名字是指在RNA从DNA转录期间或之后改变其碱基化学结构的过程。腺苷-肌苷(a -i) RNA编辑,顾名思义,涉及到脱氨的腺嘌呤,形成另一个嘌呤,次黄嘌呤(肌苷是次黄嘌呤核苷)。由于腺苷被解码为鸟嘌呤,当它出现在蛋白质编码区时,可以改变蛋白质序列,并调节多种生物过程。
Fukuda和他的同事使用了锤头核酶可以切割碱基序列UAA而不能切割UGA (U:尿嘧啶;答:腺嘌呤;G:鸟苷)和鸟苷和肌苷之间的相似性来设计一个核酶结构,只有在没有发生a -to- i取代的情况下才能切割RNA编辑靶位点。然后,他们创建了一个包含该中心基序的核酶库,在每一侧随机扩展,并选择最稳定,因此最活跃的核糖酶进行进一步测试。福田康夫说:“这种核酶可以切割未经编辑的RNA序列,但不会切割经过编辑的RNA序列,但它只有在比细胞中镁含量更高的情况下才完全活跃。”“创造一种在生理盐浓度下工作的核酶还需要进一步的修改。在几种疾病中已经观察到A-to-I RNA编辑的畸变,福田希望有一天可以使用类似的技术创造出新的核酸靶向疗法。然而,目前还不清楚这些畸变是疾病的原因还是结果。“这些技术的第一个应用可能是分子生物学研究的新工具,”Fukuda补充道。
第一个应用可能是分子生物学的工具
保加利亚索非亚大学的Robert Penchovsky正在使用类似的方法设计核酶,以检测特定小分子的存在并对其做出反应。适体是一个短的核酸序列或一个小的蛋白质,结合到一个给定的分子目标。大多数适体都是合成的,而变构核酶——只对结合在催化结构域外的配体有活性的核酶——可以通过将含有结合位点的RNA适体与催化锤头核酶融合来设计。
Penchovsky使用计算机建模设计了这种类型的分子,其中核酶在活性和非活性状态之间改变构象,以响应茶碱(一种化学性质类似于咖啡因的嘌呤)。彭科夫斯基说:“如果茶碱结合激活了核酶,这些简单的核酶就可以作为分子逻辑门,具有布尔逻辑YES函数,如果结合使核酶失效,则具有NOT函数。”“我还可以设计寡核苷酸传感核酶,作为AND门和OR门,类似的生物传感器系统已经用于抗菌药物发现的高通量筛选阵列。”“这项技术在分子计算和抗生素设计方面还有其他潜在应用,彭科夫斯基正在寻找工业合作者来进一步开发这些技术。”
核糖体
锤头核酶是相当小的,易于控制的分子,可以相对容易地合成。然而,在大分子光谱的另一端,还有其他生物学上重要的核酶。核糖体是催化蛋白质合成的“分子机器”,存在于所有活细胞中,它有两个亚基,只在蛋白质合成过程中聚集在一起,每个亚基包括许多蛋白质和RNA分子。当第一个大亚基的高分辨率结构发表时,参与研究的耶鲁大学的汤姆·施泰茨(Tom Steitz)和他的团队评论说,亚基表面到处都是蛋白质,“除了肽键形成的活跃位点和它与小亚基接触的地方”。Steitz和他的同事得出结论,非常出乎意料的是,RNA分子主要(如果不是唯一)参与了多肽的合成,蛋白质就像“钉书钉”一样将它们固定在适当的位置。他们已经确定核糖体是一种核酶。
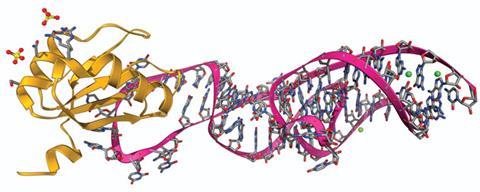
来自英国剑桥MRC分子生物学实验室的Venki Ramakrishnan,与Steitz和以色列Weizmann研究所的Ada Yonath共同获得了2009年诺贝尔化学奖,因为他对核糖体的研究。他最近投入了大量的研究来理解核糖体识别形成“停止密码子”的三个核苷酸、终止蛋白质合成并释放新形成的蛋白质的机制。标准遗传密码使用三个停止密码子,UAA, UGA和UAG, Ramakrishnan的显著结构研究——包括电子显微镜和晶体学——已经展示了一种被称为释放因子的真核蛋白质,当与核糖体结合时,如何使用碱基叠加和氢键来识别这些碱基三联体,而不是其他的。有趣的是,这也可以与布尔逻辑门进行比较,在这种情况下,一个NAND门,G由1表示,a由0表示。这两个核苷酸在第二和第三密码子位置的任何组合,除了' GG '(' 11 '),都将标志着蛋白质合成的终止。
这些发现和其他发现表明,RNA分子能够催化生命所必需的完整的最小化学反应集,这导致了一种关于生命起源的理论,称为“RNA世界”。这表明,由于RNA分子能够自我复制,并将类似dna的信息存储功能与类似蛋白质的化学催化功能结合起来,地球上的所有生命都可能是从仅由RNA组成的原始“生物”进化而来的。切赫说:“由于没有分子化石,所以不可能证明这一理论,但我们积累的关于核糖酶和RNA的所有信息表明,这不仅是可能的,而且很有可能。”
控制
科学家们甚至不可能在短时间内创造出一种结构和功能与核糖体一样复杂的核酶。但研究人员已经在对天然核糖体进行修补,以巧妙地改变它们的性质。最初,这受到限制,因为他们无法控制可用的大小核糖体亚基中哪些会形成活性复合物。然而,现在,包括MRC分子生物学实验室的Jason Chin、伊利诺伊大学的Alexander Mankin和美国西北大学的Michael Jewett在内的几个小组已经表明,设计完全正交的核糖体是可能的,其亚基由共价连接物连接,并且仍然具有催化活性。
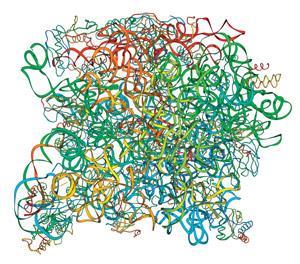
Mankin, Jewett和他们的团队设计了一种“栓系”核糖体,其中核糖核酸的大小亚基各有一个RNA成分大肠杆菌核糖体由两个聚腺苷核苷酸连接。曼金解释说:“这些连接体必须足够长,以确保亚基能够进行蛋白质合成所需的全部构象变化,但又必须足够短,以防止任何一个亚基与另一个核糖体结合。”“一个8个核苷酸和一个9个核苷酸的连接子工作得很好。这些核糖体,被称为Ribo-T,可以催化蛋白质的合成大肠杆菌细胞即使没有野生型核糖体存在,尽管没有野生型核糖体的细菌生长速度只有一半。Jewett补充说:“我们正在使用ribot进一步探索蛋白质合成的机制,我们将能够设计具有不同寻常功能的系带核糖体,最终甚至诱导它们合成蛋白质以外的聚合物。”
核糖体并不是唯一被证明是核酶的大分子机器。大多数真核生物的基因含有称为内含子的非编码片段,在转录的信使RNA到达核糖体之前,必须将内含子从转录的信使RNA中去除。在这个过程中,RNA在每个内含子的开始和结束被切割,然后编码蛋白质的外显子序列重新连接,被称为剪接,催化这个反应的蛋白质- RNA复合体是剪接体。它由5个小RNA分子、蛋白质复合物和镁离子组成,催化单元由RNA形成,并由蛋白质和离子稳定。剪接体的RNA成分的结构非常类似于一个小得多的核酶,即在所有生物的基因组中发现的自剪接II族内含子。MRC分子生物学实验室的Kiyoshi Nagai解释说:“蛋白质稳定了II组内含子的结构并增强了它们的活性,尽管它们不是催化所必需的。”“最近对剪接体的结构研究揭示了剪接体和II类自剪接内含子之间的更多相似之处,这表明可能存在共同的进化起源。”
通过对大小核酶的结构和功能的修补,已经对分子生物学和具有新颖化学和功能的分子结构产生了许多新的见解。它们肯定会在合成生物学这门新兴学科中发挥越来越重要的作用。
克莱尔·桑瑟姆,英国伦敦科普作家








暂无评论