当詹妮弗·杜德纳(Jennifer Doudna)和艾曼纽·夏彭迪埃(Emmanuelle Charpentier)透露,细菌Crispr-Cas9抗病毒防御系统可以被重新编程以编辑基因组DNA时,她们几乎无法想象这一发现会产生多大的影响。一个诺贝尔奖和十年后的基于该技术的治疗正在冲向临床。
令人印象深刻的速度将Crispr从有趣的发现发展成为可行的治疗工具考虑到它在我们操纵基因的能力方面所代表的巨大进步,这也许并不令人惊讶,他说费奥多莫斯科他是加州伯克利创新基因组学研究所的技术和翻译主任。“在遗传学最初的150年里,我们就像天文学家一样。我们可以看到恒星和星系,但我们永远无法飞到它们那里,永远无法触摸它们,”他说。
Crispr是一项一劳永逸的技术
Fyodor Urnov,创新基因组研究所
然而,Crispr却把我们变成了宇航员。在过去三年里,针对镰状细胞病、癌症和艾滋病毒/艾滋病等各种疾病的无数基于crispr的疗法通过临床试验取得了进展,它们已经表明,编辑一个人的基因组来治愈疾病是可行的。乌尔诺夫说:“这种想法本身就很古老。“但我们以前从未有过像Crispr这样的技术。”
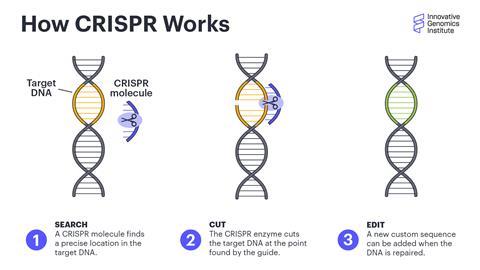
乌尔诺夫说,Crispr是开发新疗法的一种有前途和有效的工具,主要有三个原因。首先,它是高度特定的,易于定制。它基本上可以指向任何感兴趣的基因,并且应该只影响该基因。其次,因为它可以重写原生基因组,所以它有能力在一次剂量内修复遗传疾病。他说:“很多针对的疾病都是通过长期服用药物来治疗的。”“Crispr是一种一劳永逸的技术。”
最后,Crispr是非常多功能的。它可以移除或修复有缺陷的基因,添加缺失的基因等等。乌尔诺夫本人是生物技术公司Tune Therapeutics的联合创始人,该公司正在开发使用改良形式的Crispr来治疗疾病的方法,不是通过添加或删除基因,而是通过打开或关闭基因。他说,这不是一技之长。
Crispr承诺
随着新的临床试验报告结果,Crispr有望实现的例子层出不穷。大多数仍处于早期阶段,但针对的疾病范围之广,以及迄今为止主要的积极结果,意味着人们很容易对这项技术的未来感到乐观。

11月,PACT Pharma报告结果来自其基于crispr的T细胞受体(TCR)免疫肿瘤疗法的一期试验。TCR疗法类似于更常见的CAR-T细胞免疫疗法,即将一种可以与肿瘤细胞结合的经过改造的受体蛋白添加到患者的T细胞中,但在个性化癌症治疗中具有更有效的潜力。
“最大的优势是TCR可以识别癌细胞内部的情况,而不仅仅是表面的情况,”他说斯蒂芬妮Mandl他是PACT制药公司的首席科学官,因此它可以用于针对患者肿瘤的任意数量的突变。
创建个性化的TCR疗法是一个复杂的过程。首先,曼德尔的团队对患者的肿瘤和健康的血细胞进行采样,并比较两者的基因序列,以找到特定于肿瘤的突变。然后,他们使用一种算法来预测哪些突变蛋白最有可能出现在肿瘤细胞表面。然后,这些突变被用作“鱼钩”,在患者的血液中拖网,寻找可以与它们结合的T细胞受体。最后,该团队使用Crispr技术将这些受体复制到大量新鲜的T细胞中,然后将这些T细胞重新注入患者体内,在那里它们可以附着并杀死肿瘤细胞。
虽然这项工作仍处于早期阶段,在广泛应用之前还需要几年的发展,Mandl说,早期的结果显示出了希望。在参加剂量递增安全性试验的16名患者中,只有2名患者出现了明显的副作用,5名患者病情稳定。
PACT TCR疗法只是最近报道的Crispr疗法的结果。许多其他研究机构和制药公司也在推进各种疾病的治疗。
镰状的成功
目前临床上应用最广泛的是治疗血液疾病镰状细胞病和乙型地中海贫血。这两种疾病都是由在红细胞中产生血红蛋白的基因存在缺陷引起的,而由Crispr Therapeutics和Vertex Pharmaceuticals开发的基于Crispr的药物exa-cel显示出了单次剂量治愈这两种疾病的巨大前景。
Exa-cel的工作原理是用Crispr编辑患者的血液干细胞,以打开胎儿版本的血红蛋白基因,而胎儿版本的血红蛋白基因不受这两种疾病的影响。一旦化疗清除了体内患病的干细胞,编辑过的干细胞就会被重新引入骨髓,在那里它们会产生新的红细胞和健康的胎儿血红蛋白。
一期试验于2019年开始,到目前为止,已有75名镰状细胞病或乙型地中海贫血患者接受了治疗。几乎所有人的疾病都基本治愈了,只有极少数的不良副作用。二期和三期临床试验正在进行中,但两家公司计划很快向美国食品和药物管理局和欧洲药品管理局申请批准。
乌尔诺夫说,这是前所未有的。“他们能在这么短的时间内完成这么多工作,真是太不可思议了。”
PACT Pharma和Vertex/Crispr Therapeutics的治疗都是在体外进行的,这意味着患者的细胞从体内取出,用Crispr修饰,然后返回。其他公司正在寻求更直接、也更具挑战性的途径,即在体内传递Crispr,以解决人体内部的问题。
体内编辑
Intellia Therapeutics就是这样一家公司。他们有两种候选药物NTLA-2001和NTLA-2002,在早期临床试验中用于治疗转甲状腺素淀粉样变(ATTR),一种影响神经、心脏、肾脏和眼睛的蛋白质折叠障碍,以及遗传性血管性水肿,后者会导致身体各个部位严重的、不可预测的肿胀。
我们使用Crispr的目的与它在自然界中进化的目的相同,那就是抵御病毒
Daniel Dornbusch,切除生物疗法
每种疾病都是由一个基因的突变引起的,这些药物通过使用Crispr来敲除突变基因,降低有缺陷蛋白质的循环水平。药物被直接注入患者体内,Crispr机器被包裹在脂质纳米颗粒中,这些脂质纳米颗粒优先被基因最活跃的器官肝脏吸收。
目前正在进行的这两种药物的一期试验都显示出良好的安全性。体内Crispr治疗的副作用风险更高,因为基因编辑器意外地瞄准了基因组中的错误位点,但迄今为止所见的不良事件都很轻微。
Intellia负责沟通的高级副总裁伊恩·卡普(Ian Karp)说,研究还表明,这些药物可以显著减少有害蛋白质的数量,达到现有药物无法达到的水平。Crispr药物的优点是一次性治疗,而不需要每隔几天或几周就反复注射。
Crispr也被开发成治疗方法,不仅针对我们自身DNA的错误版本,还针对外来入侵。切除生物疗法公司正在测试一种治疗艾滋病毒的方法,这种方法有可能只需要一次剂量就能治愈感染。“我们使用Crispr的目的与它在自然界中进化的目的相同,那就是抵御病毒,”他说丹尼尔Dornbusch他是该公司的首席执行长。
这种疗法的工作原理是使用Crispr技术寻找将自己整合到淋巴细胞基因组中的逆转录病毒DNA,并将其去除大部分,基本上将艾滋病毒从细胞中清除。多恩布希说,尽管它是系统地施用的,但脱靶效应的风险很低。这种药物的目标是与人类基因序列截然不同的病毒DNA,因此不匹配的可能性很小。他说,到目前为止,该公司还没有在体外或动物模型中看到任何脱靶效应的证据。
切除现在已经开始了1/2期临床试验。这项研究主要关注安全性和生物分布——药物是否到达正确的组织,是否切断正确的DNA——但它也将评估参与者是否能够在不看到疾病反弹的情况下停止服用抗逆转录病毒药物。多恩布希表示,该公司计划在2023年的某个时候宣布早期安全性和可能的一些疗效数据。
成本的考虑
乌尔诺夫说,这些例子,以及许多其他正在开发中的治疗方法,表明Crispr正在成为主流治疗方法。由单个基因突变引起的疾病超过5000种,Crispr可以帮助治疗其中的大量疾病。他说:“我们正走在一条清晰的道路上,让Crispr从治疗少数罕见的遗传疾病,发展到更常见的疾病,最终预防疾病。”
第一批Crispr药物的价格可能仍会令人咂舌
未来仍有巨大的挑战。克服潜在的安全问题是其中之一,但最大的挑战将是健康正义;确保Crispr的好处不仅仅局限于那些负担得起的人,也不仅仅局限于那些足够普遍的疾病,这些疾病足以证明投资是合理的,并有望为公司带来巨大回报。
虽然Crispr有可能比其他基因疗法便宜得多,也更容易获得,但第一批Crispr药物的价格可能仍然令人难以置信。其他基因疗法的费用从每名患者每年50万美元(406000英镑)到350万美元不等。乌尔诺夫预计,Vertex公司和Crispr Therapeutics公司的镰状细胞病药物定价将“超过200万美元”,这将带来获取问题,因为美国大多数镰状细胞病患者没有私人健康保险。
乌尔诺夫说:“如果Crispr药物的价格为300万美元,那么它们将只用于患者数量合理的疾病。”“但是世界上有6000种罕见的基因疾病,谁能找到治愈它们的方法呢?””
乌尔诺夫说,尽管面临这些挑战,Crispr成为革命性新治疗技术的前景是无与伦比的。他说:“Crispr并不是一种渐进式的进步,而是一种从根本上不同的实现目标的方式。”“这并不是一个更好的捕鼠器——Crispr是一只猫。”










暂无评论