化学键通常随着参与原子间电负性差的增大而增强。但科学家们现在发现的证据破坏了他们所说的教科书知识:在某些情况下,决定键强度趋势的是原子大小的差异,而不是电负性的差异。
研究负责人指出:“电负性模型的一个显著例外是一系列碳-卤素键,具有讽刺意味的是,这是一个说明这种过于简化方法的流行例子。马提亚Bickelhaupt来自荷兰阿姆斯特丹自由大学和内梅亨大学。
分子的结构和反应性很大程度上取决于化学键的稳定性和长度,因此了解这些参数在元素周期表中不同元素组合的变化是至关重要的。化学键专家说:“这可以帮助科学家设计出更好的方法来生产新分子,比如药物化合物和功能材料。凯瑟琳Esterhuysen他没有参与这项研究。
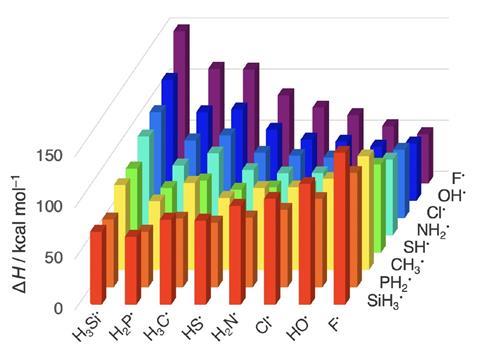
Bickelhaupt的同事解释说,利用密度泛函理论,荷兰团队分析了“元素-元素键”,涉及周期2和3的原子以及14到17的基团,它们代表了周期表中一系列系统的原型成键情况特雷弗·哈姆林.“这些化学键在化学科学中无处不在,在天然产物、化学物质和材料中也很常见。”
“研究人员表明,在一段时间内,电负性的变化确实是键强度趋势的起源;在一个群体中,传统的模式被打破了,”Esterhuysen评论道。
她解释说,Bickelhaupt的团队仔细分析了两个原子之间的键能是如何随着它们靠近而变化的。由于电子和原子核相互作用的方式不同,这种能量变化有几个组成部分。Esterhuysen解释说:“研究人员利用激活应变模型和能量分解分析,将键能分解成不同的成分,然后检查它们的相对影响。”这使他们能够确定不同化学键形成背后的驱动力,并找出这些化学键是如何随着时间和群体变化的。
这是一个有趣的提醒,在科学中,我们应该始终小心给出一个简单的答案
斯泰伦博斯大学的Catharine Esterhuysen
“在一段时间内,例如从碳-碳到碳-氟,键会加强,因为它们之间的电负性差会随着电子对在电负性更强的原子上越来越稳定而增加,”比克豪普特观察到。但是“在一个基团中,例如从碳-氟到碳-碘,通过空间泡利排斥的增加,有效原子大小的增加是键变弱的原因。”
比克豪普特补充说,这项研究评估了多个元素-元素之间的距离,而不仅仅是平衡几何,这一点很重要,因为这是找出是什么驱动键形成的唯一方法。他说:“我们直观的‘有效原子大小键机制’可以用于理解元素周期表中多个系列键的键长和强度。”
埃斯特胡森说:“这是一个有趣的提醒,在科学中,我们应该始终小心给出一个简单的答案。”“正如(研究人员)指出的那样,如果人们真的想全面了解成键机制,就必须在深层次和基础层面上进行研究。”
参考文献
E勃洛克等,化学。欧元。J。, 2021, doi:10.1002 / chem.202103544








1读者的评论