新的研究表明,温度可以严重影响蛋白质的构象状态和配体结合特性。因此,仅基于低温结构数据的计算模型可能产生误导性的结果。
几乎所有用于测定蛋白质结构的晶体学数据集都是在低温下获得的。蛋白质晶体用液氮冷冻冷却,当晶体受到x射线轰击时,低温条件有助于限制x射线损伤,这使得用户可以收集高分辨率的完整数据集。虽然会造成更多的晶体损伤,但也可以在室温下进行实验。许多蛋白质具有弹性,因此具有动态结构,某些构象态可能只有在室温下才能达到。因此,在低温条件下研究蛋白质时,用户可能无法观察或正确捕获蛋白质在自然生物温度下的主要构象状态。此外,如果多种蛋白质构象是可能的,那么它们可能在不同的温度下以不同的比例出现。
现在,马库斯•菲舍尔美国田纳西州圣裘德儿童研究医院的教授和他的同事们首次对蛋白质结构中的温度伪效应进行了系统分析。“人们可能过度解读了实际上是冷冻文物的数据。当你只看冷冻-并开始优化…你可能会被误导。你就是不知道。”
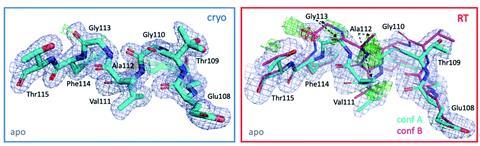
研究小组通过观察T4溶菌酶L99A模型系统开始了他们的研究,该模型系统在蛋白质数据库(PDB)中有700多个结构。然而,在收集了迄今为止在低温和室温下的9个数据集对的最大温度序列后,Fischer的团队观察到一个与配体结合相关的新的载波螺旋确认。费舍尔说:“这就是我们在这里提倡的。”“室温可以为配体设计和发现的构象景观提供额外的见解。”
计算建模对于现代药物发现和设计至关重要,对于配体对接研究转化为成功的药物发现,起始蛋白模型尽可能真实地反映体内靶标至关重要。通过收集14个新的高分辨率数据集,并将这些数据集与PDB的数据集相结合,该团队可以分析9对T4溶菌酶L99A结构(在低温和室温下)。他们发现超过三分之一的残基,大多数位于配体结合位点附近,对温度变化有反应。他们还检查了数百个数据集的配体结合和占用,揭示了在室温下新的配体结合姿势。该研究扩展到其他四种蛋白质类别,并清楚地表明室温结构可以提供低温结构无法捕获的见解。将收集到的数据作为建模研究的起点,表明替代特征可以(也许应该)被仔细建模,而不是作为次要状态被丢弃。澳门万博公司
“结构是快照”
”那些将结晶学结果作为未来实验基础的人应该意识到其局限性。埃莉诺·道森他是英国约克大学的名誉教授,也是蛋白质晶体学计算建模方面的专家。结果会受到温度、结晶条件、辐射损伤等因素的影响。一个结构就是一个快照。好的建模工具应该把这些结果考虑在内,但计算建模也必须处理近似值。”
Cryoprotection先锋埃尔斯佩思可他说,计算建模工具的开发人员应该注意到这项研究:“PDB低温结构不像室温结构那样是有效的训练集。由于串行同步晶体学和可靠的数据分析软件的发展,可以合并来自许多不同晶体的数据,室温晶体学正在经历复兴,这将扩大PDB中室温结构的数量,并扩大基于人工智能的计算建模工具的室温结构训练集。
虽然这项研究强调了依赖低温结构的缺点,基思•威尔逊英国约克大学蛋白质结晶学方法开发专家,他说,在研究生物活性大分子时,室温数据收集并不总是可能的:“对于大多数蛋白质,室温数据收集会导致晶体快速死亡,需要大量的晶体来记录一套完整的数据。”室温数据收集,包括板内原位技术,已应用于低温冷冻已被证明难以处理的晶体,如许多膜蛋白。但这再次意味着需要大量的晶体才能获得完整的数据。我认为低温数据收集将继续成为绝大多数项目的标准。对于大多数研究来说,记录室温数据太具有挑战性了。”
然而,费舍尔热衷于鼓励更多的研究人员尝试室温实验。“除了时间和一点钱,你不会损失什么,但你获得的见解——这几乎是一个新的实验。”你会得到很多不同的新见解,值得一试。”









暂无评论