小分子制造商多伦多研究化学公司帮助药物配方商消除开发管道中的杂质,确保更安全的产品进入市场
即使是少量的药物杂质也会对健康产生严重的负面影响,并影响药物的行为和疗效。这危及病人的安全。一个研究小组发现,在2001年至2010年期间,美国食品和药物管理局(FDA)批准的222种新疗法中,有71种(32%)受到安全问题(指定的上市后安全事件)的影响。该公司表示,有3次撤机,61次盒装警告和59次安全通信2017年调查。
由于杂质检测或其他安全原因导致的产品召回对消费者和制药公司都可能产生重大后果。患者主要面临药物污染的风险,但生产商必须承担潜在的收入损失和罚款。公众对该行业的看法也是一个关键因素。
2018年,FDA报告称,多种含有活性药物成分(API)缬沙坦的血管紧张素受体阻滞剂(arb)被发现含有n -亚硝基二甲胺(NDMA)及n -亚硝基二乙胺(NDEA)杂质。由于潜在的危险,该报告立即引起了恐慌,并引发了产品召回。
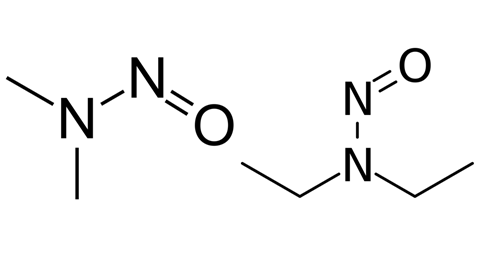
NDMA的致癌性为首次报道1956年,NDEA在1967年。就像亚硝胺家族一样,它们被国际癌症研究机构和美国列为“可能的人类致癌物”环境保护署。尽管在食品中存在少量的亚硝胺,但ARBs(用于治疗高血压、心力衰竭和肾脏疾病)中亚硝胺的存在引起了广泛的警报。
产品召回对消费者和制药公司都有重大影响
随后的召回影响了多种疗法,包括含有缬沙坦、氯沙坦和厄贝沙坦的ARB批次,并在此后的几年里影响了其他药物。2020年4月,FDA呼吁立即撤军市场上所有雷尼替丁(善得得)产品的召回,以及糖尿病药物的自愿召回二甲双胍正在进行中。
问题的根源
包括立法失败在内的一些问题可能放大了NDMA的广泛药物污染。许多涉及的治疗方法都是通用的,美国90%的处方药都是通用的。一个充斥着来自多个制造商的产品的市场变得更难监控,尤其是当这个市场是全球化的时候。根据FDA的说法2019年,在美国销售的所有药物中,只有28%的原料药生产设施位于美国。近五分之一在印度,13%在中国,是2010年的两倍。
2019年FDA在海外的检查次数也有所下降,仅在中国进行了125次检查,比2018年减少11%,比2017年减少24%彭博社调查显示。由于召回影响到全球大型仿制药制造商的产品,因此检查制度必须严格,生产商的持续检测对于保护消费者至关重要。了解杂质是如何形成的对于防止它们进入最终药品至关重要。通过准确监测和防止它们的形成,具有潜在有害杂质的药物将不会进入市场。杂质可能出现在药物制剂管道的任何阶段。环境因素(如温度或湿度)以及设备污染、剂型或药物降解都会导致这些问题。
有机杂质形成
有机杂质分为若干类。它们可以是药物原料药或起始原料的降解物、生产过程的非预期副产物或未转化的生产中间体。一种原料药未能从其合成过程中涉及的其他材料中分离出来——例如未反应的起始材料或中间体——就是这样一个例子。当合成过程中形成的副产物没有与活性化合物完全分离时,也会产生杂质。
随着时间的推移,药物的不稳定性也会导致原料药降解产生有机杂质。例如,FDA召回雷尼替丁是基于越来越多的热不稳定API的证据。
有机杂质已知对人体健康有害,因此有必要严格限制其在原料药中的存在
许多有机杂质,如亚硝胺,已知对人体健康有害,监管机构和政府对其在原料药中的存在设定了严格的限制。如果超过阈值,杂质的鉴定可能是必要的,导致昂贵的毒性研究。稳健的质量保证(QA)是防止有机杂质污染的最佳防御。定期测试多个批次的产品使用参考标准-可用于测试物质的特性、强度、质量和纯度的高特性材料应构成质量保证过程的一部分。
无机和残留溶剂杂质
无机杂质,如容器、过滤器和机械中使用的试剂、配体、催化剂、无机盐和重金属,更容易预防和控制。使用除盐水和玻璃衬里的容器,并仔细监控生产过程的每个阶段,这是良好的做法。
用于制造药物化合物的溶剂很难完全去除,这意味着残留在产品上。因此,溶剂根据其对人类健康的风险进行分类,并对每日安全暴露设置了严格的限制。只有最安全的药物才被批准用于药物配方,并且它们需要检测制度来确保持续的消费者安全。
根据化合物的复杂程度和纯度要求,可以使用不同的技术组合

高效液相色谱(HPLC)与紫外检测确定大多数药物的杂质。定量可以对照杂质本身的外部标准进行,也可以与原料药的反应进行比较。根据化合物的复杂程度和纯度要求,可以使用不同的技术组合。
无论采用何种途径,独立合成的纯杂质样品都是非常有用的。将检测到的杂质的光谱和色谱剖面与已知的纯参比相匹配,为验证结构提供了必要的基准。获得足够数量的杂质可以进一步研究,从而充分了解其毒理学作用和形成机制。这一实践为杂质阈值安全规定提供了依据。
在LGC,我们的TRC药物杂质标准组合为140多个国家的药物开发、医学和生物医学研究专业人员提供支持。
我们的团队拥有超过250名高技能的化学家,专门为新的和已知的化合物设计最佳的合成路线,从杂质到定制的化合物和稀有有机物。
案例研究:阿托伐他汀杂质的合成
阿托伐他汀的环氧吡咯沙嗪三基(EPT)钾盐杂质的复杂合成中可以看到药物杂质分析的挑战。
这种EPT盐杂质(A791895)是阿托伐他汀的光降解产物,阿托伐他汀是一种选择性的、竞争性的HMG-CoA还原酶,品牌名为立普妥。它是同类药物中唯一一种专门用于降低高胆固醇血症患者高ldl -胆固醇和甘油三酯的药物。三环杂质可引起药物使用者的不良反应。因此,它被列入强制性杂质清单,任何药品制造商在提交新药申请之前都必须对其进行检测。
在所有与阿托伐他汀光降解相关的杂质中,EPT钾盐可以说是最难制备的之一。迄今为止,文献中还没有报道过该合成物,因此很难获得作为标准使用。一位研究人员联系了我们,他们需要EPT钾盐,但无法找到适合他们分析需求的纯度水平的分子。我们的任务是开发一种纯度达到要求的合成物,以保证分离量。
尽管其表面复杂,该产品是由先进的阿托伐他汀双环杂质分两步制备的。然而,这种高度紧张的三环分子对热和质子溶剂都很敏感(即使在0°C也会缓慢降解),限制了我们在纯化方法和试剂方面的选择,以影响合成步骤。
另一种乙醚溶液被证明是从甲酯中间体中生成所需的K+杂质的最佳试剂。同样,由于A791895在合适的核磁共振溶剂中的稳定性有限,杂质的结构是通过酯前驱体间接验证的。
2D-NMR研究包括dqfCOSY, NOSY, HSQC, hbc - hc序列(以及通常的H1, C13和F19 NMR测量)提供了基本信息,使研究实验室能够获得适当纯度水平的EPT钾盐供应。
不杂质的情况是不断变化的。TRC很自豪能够支持这项重要的研究,并保障全球消费者的治疗质量和福祉。我们的团队所做的工作促进了科学,使世界更加安全。
欢迎来到制药行业的前沿
- 1
- 2
 目前阅读
目前阅读
药品杂质:对抗制药业难以捉摸的威胁
- 3.
- 4
- 5















暂无评论