克莱尔·桑瑟姆揭示了剪接体的复杂世界,剪接体是我们所有细胞中的分子机器
20年前,当人类基因组计划即将结束时,英国剑桥附近的欧洲生物信息学研究所的尤恩·伯尼(Ewan Birney)就当时最热门的问题之一——人类基因组中有多少个基因——设立了一个在线抽奖活动。他们下了200多个赌注,平均预测了超过6万个基因。最终的答案出乎意料,或许也令人失望:由美国西雅图系统生物学研究所的李·罗文(Lee Rowen)开出的25947英镑的中奖赌注是所有中奖赌注中最低的,而且仍然被高估了。目前已知,人类基因组中蛋白质编码基因的数量约为20400个:仅比一毫米长的线虫的数量多一点,线虫是全世界遗传学家喜爱的一种简单的模式生物。其他脊椎动物也有类似大小的基因组。
相对较少的基因如何导致脊椎动物生物学的巨大复杂性和多样性,这是一个复杂的难题,但它的主要解决方案可以在基因组和蛋白质组之间的路径中找到。几乎所有学过高中生物学的人都熟悉分子生物学的中心法则:DNA制造RNA制造蛋白质。这基本上总结了细菌中发生的事情:蛋白质合成的“分子机器”,核糖体,抓住信使RNA (mRNA),立即合成并开始制造蛋白质。这一过程的电子显微照片将显示被核糖体装饰的mRNA,就像串在绳子上的珠子一样。
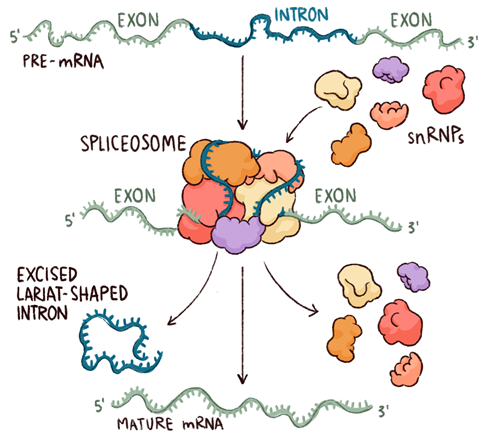
在真核生物中——也就是所有含有细胞核的生物,从变形虫、蠕虫到人类——同样的中心法则掩盖了一个复杂得多的过程。信使RNA是由组成基因的DNA直接合成的,就像在细菌中一样,但这是一种不成熟的“pre-mRNA”,必须经过连续的化学修饰,并从形成它的细胞核中输出,然后才能用于蛋白质合成。其中两种修饰,即在转录开始的前mrna末端(5 '端)添加一个单核苷酸帽,在其3 ' '尾部添加一个多聚腺苷序列,是直接而通用的。正是这些修饰中第三种也是最复杂的,剪接,导致了脊椎动物中蛋白质储备的异常扩张,并可以说,导致了它们复杂的生物学。
剪接是将DNA的非编码片段(即内含子)从pre-mRNA中移除,并将剩余的外显子连接成一个长长的蛋白质编码序列的过程。几乎所有的真核生物都使用它,但更复杂的生物的基因结构更频繁地使用它。选择性剪接,即来自同一基因的不同外显子组可以连接形成不同的蛋白质,发生在大约95%的人类基因中。有人认为,我们基因组中仅2万个左右的基因就可能产生多达50万种不同的蛋白质。
结构性问题
如果你想了解一个生物过程的机制,了解所涉及的蛋白质的结构是有帮助的。早在1958年,剑桥大学MRC分子生物学实验室(LMB)的Max Perutz和他的同事们发表了第一个蛋白质结构——血红蛋白——之后,人们就了解了这一点。然而,直到最近,像剪接这样复杂的过程以及驱动剪接的分子机器——剪接体——似乎不可能向结构生物学家揭示其秘密。
一位结构生物学家将永远与这个复杂而优雅的分子机器机制联系在一起:领导LMB剪接体小组的永井清。20世纪70年代末,他离开祖国日本,作为学生访问学者与佩鲁茨一起工作,最初研究血红蛋白,给他的老板留下了深刻的印象,并于1981年被邀请回国做博士后。六年后,他被授予终身教职,并在那里度过了余生:2019年9月,他以相对年轻的70岁去世时,他仍在担任小组组长。

LMB不仅被称为英国的“诺贝尔奖工厂”——在那里工作的科学家获得了12个奖项,除了3个是化学奖以外——而且它以愉快和高效的工作环境而闻名。永井的亲密合作者Chris Oubridge是另一位留下来的LMB科学家。他在1988年获得第一个学位后就来到了这里,从那时起就一直在那里工作。乌布里奇回忆说:“在实验室主任Aaron Klug说服永井离开血红蛋白项目并涉足一个新的研究领域后不久,我就加入了这个小组。”正是克鲁格第一次向永井提出他的研究方向是rna结合蛋白。克鲁格1982年获得诺贝尔化学奖,部分原因是他在dna -蛋白质结合方面的研究。“DNA几乎总是形成著名的双螺旋结构,而RNA的结构则更加多样,而且往往更加脆弱。”乌布里奇说:“对于20世纪80年代的结构生物学家来说,这些rna -蛋白质复合物比dna -蛋白质复合物更具有挑战性,但清先生很快证明了他能够应对这一挑战。”
永井的早期工作导致了一种与RNA结合相关的新型蛋白质结构的发现。这包括一个小的β薄片,一侧有两个螺旋,RNA与另一侧结合。幸运的是,一些最早发现的含有这种基序的蛋白质——现在被称为RNA识别基序,或RRM——是剪接体的蛋白质成分,或者更确切地说,剪接体的部分蛋白质成分。研究rna -蛋白质在这些小结构中的结合激发了永井的兴趣,使他的工作在他的职业生涯中继续前进。
这个结构在能量上是不利的,所以我们花了这么长时间才得到足够好的晶体并解出这个结构也就不足为奇了
作为分子,剪接体本身既庞大又极其复杂。首先,它很像核糖体,由非活性时独立存在的亚基组成,只在核酸周围聚集,形成活性机器。然而,核糖体有两个亚基,每个亚基由许多蛋白质和rna组成,而完整的剪接体包括五种所谓的“小核核糖核蛋白”(snRNPs,通常发音为“snurps”)和许多相关蛋白质。snRNPs含有富含尿嘧啶的RNA,尿嘧啶是一种取代DNA胸腺嘧啶的RNA碱基,它们被命名为U1, U2, U4, U5和U6,也许没有想象力。Nagai首先利用核磁共振和x射线晶体学研究U1和U4 snRNPs的部分结构。U4核心粒子的结构显示,7个蛋白质排列在紧密缠绕的RNA片段周围。乌布里奇解释说:“这种结构在能量上是不利的,只有镁离子才能稳定下来,镁离子可以中和带负电荷的RNA磷酸盐。”“我们花了这么长时间才获得足够好的晶体,并把结构解析到原子级别,这并不奇怪。“这7种蛋白质都含有Sm基序,并结合形成一个连续的、来回的β表。这个环存在于除了U6之外的所有snRNPs中,U6具有类似的LSm结构。完整的U1 snRNP颗粒具有较长的RNA, 7个常见的Sm蛋白和其他3个; solving it by x-ray crystallography took well over 10 years.
未来的技术
然而,整个复合体的结构不太可能仅用这两种技术就能解决,因为它有5个snRNPs和与核酸结合的相关蛋白质。要获得像活性剪接体这样大的、动态的、脆弱的分子复合物的结构,只有一种技术可以做到:电子显微镜(EM),“结构生物学的傲慢新贵”,正如欧洲新闻编辑Eric Hand所说科学,描述它。
电子显微镜作为结构生物学家武器库中的一种潜在工具已经存在了几十年:Klug在1982年的诺贝尔奖中提到了他的“结晶电子显微镜的发展”。但在21世纪10年代之前,EM获得的分子图像的分辨率仍然很差。晶体学家和核磁共振波谱学家对自己在ångstrom水平上辨别反应机制的能力感到自豪,有时会轻蔑地称其为“blobology”。然而,在过去十年中,显微镜功率、实验技术和计算分析的改进已经使这门学科变得面目全非。汉德将其描述为“在分辨率上挑战晶体学,在范围上超越它”。虽然进入蛋白质数据库的x射线结构的数量在2018年达到顶峰,但数量少得多的EM结构正在呈指数级增长。“x射线晶体学不会完全消亡,因为它是目前最好的技术,例如,研究酶的详细机制,但电子显微镜可能会在许多应用上取代它,”负责管理LMB的三个巨大的克里奥斯电子显微镜的陈绍霞说。
实验只能在体外进行,因为如果你在细胞中停止剪接,它们就会死亡
虽然将蛋白质置于电子显微镜下并不需要制造晶体——这是该技术相对于晶体学的优势之一——但样品制备仍然很棘手。理解像剪接体这样的动态结构的分子机制需要多个结构,每个结构都在不同的点上冻结在其构象中。Clément Charenton是永井团队的博士后,他解释了他和他的同事如何在不同的时间点捕获剪接体。“这些实验只能进行在体外因为如果你停止细胞中的剪接机制,它们就会死亡。”“然而,在试管中使用pre-mRNA和剪接体组件建立剪接反应是有可能的,pre-mRNA可以发生突变,这样剪接过程就会停止,在机制的同一点产生含有复合物的样本。”
到目前为止,这种通用技术已经在人类或酵母剪接过程中的八个不同点上获得了剪接体复合体的结构,说明了它是多么异常复杂。当底物结合时,大多数酶的活性位点已经形成,而剪接体必须在核酸上组装其活性位点。然后它必须使RNA上的反应基团靠近在一起,催化两个不同的反应,它们之间有进一步的构象变化,最后解离释放产物。永井和他的同事,以及石毅功(中国北京清华大学)、Reinhard Lührmann(德国马克斯普朗克生物物理化学研究所Göttingen)和赵睿(美国科罗拉多大学)的团队解决的许多复合物,使他们能够完全重建这一结构。永井研究小组的研究生马克斯·威尔金森(Max Wilkinson)已经做出了剪接机制的影片使用分子绘图程序PyMol。从整体上看,它们就像一场精心编排的芭蕾舞。威尔金森说:澳门万博公司“使用这些电影比只看静态图像更容易看到和理解综合体的一些特征。”
在化学上,由剪接体催化的反应都是酯交换,其中一个酯通过一个烷氧基与一个醇交换而变成另一个酯。这种相对简单的反应需要金属离子结合到活性位点上,首先用于释放5 '外显子的末端,然后在一系列构象变化后,将其与3 '外显子连接,释放出一个称为套索的套索状内含子。
错误的事
在像拼接这样复杂的过程中出现错误并不奇怪。各种形式的错误剪接与越来越多的疾病有关,剪接缺陷经常出现在癌细胞中。因此,剪接体正在成为一种重要的新药物靶点。一些化合物,包括大环pladienolide B,已被确定与癌细胞中的剪接体成分结合,并通过剪接抑制诱导细胞死亡。具有类似机制的化合物成为有用的化疗药物并非不可能。此外,通过与特定rna结合来调节剪接的反义寡核苷酸正在开发中,用于治疗退行性疾病,如肌萎缩性侧索硬化症(也称为运动神经元疾病)和杜氏肌营养不良。
脊髓性肌肉萎缩(SMA)是另一种由剪接过程中的缺陷引起的退行性疾病,尽管这次更加间接。它是由运动神经元死亡引起的,导致或多或少程度的进行性肌肉萎缩。携带最严重变异的婴儿只能活几周或几个月,而携带最轻微变异的人可以正常寿命,但从成年早期开始虚弱加重。20世纪90年代初,当基因定位技术还处于起步阶段时,人们进行了艰苦的工作,将这种疾病的病因追溯到一种后来被命名为SMN(用于运动神经元存活)的基因缺陷。几乎在同一时间,美国宾夕法尼亚大学的吉迪恩·德莱弗斯(Gideon Dreyfuss)发现了一种蛋白,它似乎以一种独特的方式与许多rna结合蛋白结合,并最终识别出它是SMN的蛋白产物。德莱弗斯说:“我们发现SMN是构建snRNPs的分子机器的核心,它招募了在每个snRNA周围形成环状结构的7种蛋白质。”“没有SMN的细胞根本无法存活,它的减少导致剪接缺陷和不同类型的疾病。”
SMN蛋白和复合物的其他成分的结构,许多是由Dreyfuss的小组获得的,显示了它如何在核酸周围组装snRNPs的蛋白质成分。他说:“我们推断出了snRNP前体的结构,这些结构在几十年前就被预测过,但以前从未见过,并揭示了活性氧和SMN功能丧失之间的联系。”“我们现在正在开发快速、灵敏的检测方法来检测调节这种功能的化合物,这可能会被证明是有用的药物先导。”
随着人们对人类mRNA的合成和解码,以及所涉及的分子机器的结构和化学了解的越来越多,进一步的毁灭性疾病将变得可以通过药物干预来解决。如果是这样,未来的患者将非常感谢德莱弗斯和永井这样的结构生物学家。
克莱尔·桑瑟姆是一位生活在剑桥的科学作家、英国











暂无评论