迈克·萨顿讲述了约翰·肯德尔和他为揭示蛋白质结构所做的工作的故事
1939年至1945年间,许多英国科学家积极参与战时项目。但是,尽管他们的专业知识在关键时刻可能至关重要,但他们的日常工作量往往主要是行政工作。在查尔斯·珀西·斯诺的小说里新人们,一个虚构的科学家可能代表了许多现实生活中的科学家,他宣称,当和平回归时,他会“把我的公文箱放在我的公文箱上,回去做一些值得做的事情”。
然而,对于许多返回学术界的人来说,找到“值得做的事情”是有问题的,因为强制的职业休假让他们重新思考自己的目标,寻求令人兴奋的新挑战。100年前的这个月出生的约翰·肯德鲁就是这样一位冒险家。战争开始时,他是一名物理化学家,刚刚开始研究反应动力学。当它得出结论时,他想用x射线晶体学来研究生物学上重要的分子。然而,正如他后来在1962年的诺贝尔奖演讲中回忆的那样:“我自己对这种方法几乎完全无知,这是幸运的,因为它向我隐瞒了当代x射线晶体学技术在解决包含数千个原子的分子结构方面所需要的程度;这的确是无知为福的例子。”
为了弥补这种无知,肯德鲁在ICI研究基金的支持下,来到了剑桥大学的卡文迪什实验室。劳伦斯·布拉格和马克斯·佩鲁茨也在那里进行类似的调查,弗朗西斯·克里克和詹姆斯·沃森后来也开始和他们一起研究DNA。在这个知识的温室里,肯德鲁的事业如日中天。但那时他已经走了很长一段路。
早年
约翰·考德里·肯德鲁1917年3月24日出生在牛津大学,他的父亲是牛津大学气候学专业的一名读者,负责抚养他长大。(他的母亲是一位艺术历史学家,她的大部分职业生涯都在佛罗伦萨度过。)在剑桥大学,肯德尔在学位的第一部分学习了物理、化学、生物化学和数学,第二部分专攻化学,并于1939年获得一等荣誉。到1940年2月。他为空军部工作——最初是雷达,但很快就有了更广泛的工作。
英国新的基于雷达的防空系统需要指挥链上下有效的信息流动,为了组织更好的通信网络,一种被称为运筹的革命性的数据分析方法被开发出来。事实证明,它有更广泛的应用,肯德鲁成为许多科学家之一,在紧急的后勤和战略问题上使用它。
他遇到了莱纳斯·鲍林,鲍林在20世纪30年代曾尝试用x射线衍射分析蛋白质
这项工作带着肯德鲁环游世界,导致了两次影响他战后职业生涯的邂逅。在斯里兰卡,他与约翰·德斯蒙德·伯纳尔(John Desmond Bernal)进行了交谈。伯纳尔当时是一位高级政府科学家,但此前是一位杰出的x射线晶体学家。在一次前往美国的军事任务中,他遇到了化学家莱纳斯·鲍林(Linus Pauling),鲍林目前也在参与战争工作。鲍林在20世纪30年代曾尝试用x射线衍射分析蛋白质,尽管结果有限。
战争结束时,他是英国皇家空军的一名荣誉联队指挥官,他本可以在战后继续为政府服务。相反,他回到了剑桥,但没有继续他的战前博士项目。部分由于他与伯纳尔和鲍林的谈话,他在佩鲁茨的指导下选择了一条新的研究路线。
佩鲁茨是一位犹太血统的奥地利化学家,他于20世纪30年代开始在剑桥大学研究蛋白质,在政治发展使他回家变得危险后,他留在了那里。1939年,他和其他数千名“敌方外国人”一起被拘留,但后来被释放,为英国的秘密军事项目工作。
战争结束后,佩鲁茨回到剑桥,在医学研究委员会的资助下成立了一个分子生物学小组,肯德尔也加入了这个小组。在完成博士学位后,肯德鲁继续与佩鲁茨一起工作,并于1962年与他共同获得诺贝尔化学奖。但是,尽管他们的研究极具创新性,但却建立在其他人已经奠定的基础上。
站在巨人的肩上
1912年,德国物理学家马克斯·冯·劳埃(在保罗·克尼平和沃尔特·弗里德里希的协助下)证明,晶体中有序排列的原子可以在x射线束中产生干涉图案——就像间隔更宽的规则结构通过与较长的可见光波相互作用产生类似的图案一样。一年后,在英国,劳伦斯(Lawrence)和威廉·布拉格(William Bragg)运用这种技术证明了普通盐晶体中的原子具有立方体结构,类似于晶体本身的外部形状。
像氯化钠这样的二元化合物为它们晶体的内部组织提供了明显的线索。即使是像萘这样更复杂的分子,在试图解释x射线结果之前,物理和化学数据也可以缩小可能结构的范围。但事实证明,探索具有生物学意义(而且大得多)的分子是极其困难的。
成功与否通常取决于研究者在脑海中形成3D结构图像的能力
在两次世界大战之间的那些年里,接受这一挑战的人包括剑桥大学的伯纳尔和他在牛津大学的前研究生多萝西·霍奇金。他们的第一个问题是为这些微妙的(通常非常不合作的)物质制备可用的晶体。当最终得到晶体时,用单色x射线照射它,然后把它的衍射图样记录在照相板上。这个操作一遍又一遍地重复,每次晶体的角度都不一样。
结果照片中的每个点都记录了部分x射线束被晶体原子转移的情况。每个光点的强度和位置表明了这部分射线的强度和它被转移的角度。起初,对这些数字的分析只能得出一个分子结构的大致轮廓,尽管它可能支持(或排除)已经根据化学原理提出的结构。
两种数学工具(傅里叶合成和帕特森函数)在这项努力中很有帮助,但要得到结果仍然需要几个月甚至几年的努力。成功与否往往取决于研究者能否在脑海中形成与衍射数据和物质已知化学性质相一致的三维结构图像。
霍奇金尤其擅长于此。1942年,她制作了第一个具有生物学意义的完整分子结构(胆固醇,分子量约为385)。另一个突破发生在1945年,当时她使用了一台机械计算机,用穿孔卡片编程,便于计算,这使她得到了青霉素的结构(分子量约330)。但直到十年后电子计算机问世,佩鲁茨和肯德鲁在更大分子上的成功才成为可能。
发现生命的组成部分
血红蛋白作为血液氧气载体的角色使其成为研究的主要目标。早期的研究表明,这种分子包括4个含铁的血红素单位和4个蛋白质链。但它的巨大体积(分子量超过64000)阻碍了佩鲁茨对其结构的研究。1949年,当肯德鲁完成他的博士学位时,这一研究仍在进行中——他的博士学位是对成年绵羊和胎儿绵羊血红蛋白的比较研究。
佩鲁茨最终在1959年实现了他的目标,但与此同时,肯德鲁专注于肌红蛋白,它在肌肉组织中储存氧气,分子量约为17000。他从鲸鱼肉中提取了这种物质——潜水哺乳动物的肌肉中含有异常丰富的肌红蛋白——但他很难制备出足够大、足够稳定的晶体来进行x射线分析。
肯德鲁成功的一个关键因素是他采用了一种强大但在技术上具有挑战性的晶体学技术——同构替代。伯纳尔、霍奇金和其他人通过比较两种成分略有不同的晶体产生的x射线衍射图,获得了有关具有生物学意义的分子的宝贵数据。这些差异可以揭示组成晶体的分子结构的重要信息。一般来说,这一对中的一个是天然存在的物质,另一个是由它合成的,方法是用同族中较重的原子取代它的一个原子,或者在结晶过程中向母液中添加较重的原子。佩鲁兹改进了这项技术,肯德鲁最终进一步发展了这项技术——但首先,他必须找到一种可以被原子取代的元素,进入肌红蛋白分子,然后说服这种新化合物形成可用的晶体。这不是一项容易的任务。
在他的诺贝尔奖演讲中,肯德鲁解释说,他和他的助手们多次尝试将更重的原子插入肌红蛋白分子中,插入理论预测的合适位置。当这些努力失败后,他们又回到了更经验的方法,在金属离子的存在下使肌红蛋白结晶,然后观察x射线模式是否有任何变化。然后进一步分析确定是否如所愿在一个地点发生了取代。在缺乏可靠的理论基础的情况下,在找到两三个合适的配体之前,有必要考察几百种可能的配体。
在他的诺贝尔奖演讲中,肯德鲁解释说,他和他的助手们多次尝试将更重的原子插入肌红蛋白分子中,插入理论预测的合适位置。当这些努力失败后,他们又回到了更经验的方法,在金属离子的存在下使肌红蛋白结晶,然后观察x射线模式是否有任何变化。然后进一步分析确定是否如所愿在一个地点发生了取代。在缺乏可靠的理论基础的情况下,在找到两三个合适的配体之前,有必要考察几百种可能的配体。
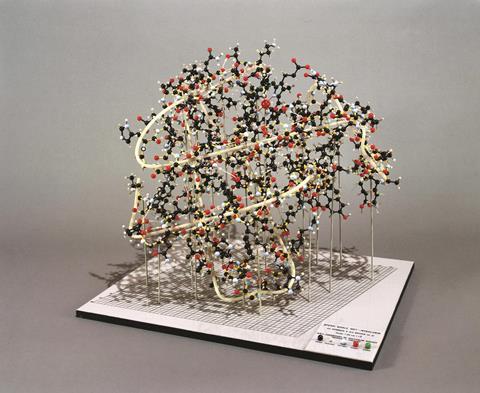
分析了许多天然肌红蛋白和改良肌红蛋白的x射线衍射图,最终使他开始绘制分子的3D结构。这需要处理大量的数据。一个肌红蛋白晶体的完整衍射图样,由许多单独的观察合成,由至少25,000个单独的斑点(称为反射)组成。肯德尔解释说,1955年,当研究小组开始将这些数据转换成分子的3D地图时,没有任何计算机能够足够快地计算包含这么多项的傅里叶合成。
1957年,来自400次反射的数据进入Edsac I——当时存在的为数不多的电子计算机之一。它生成了肌红蛋白的电子密度图,分辨率为6Å。虽然分子的结构是不规则和不对称的,但它的大致轮廓是相当清楚的。
1959年,通过对9600次反射的分析,我们得到了更为详细的图像。处理大量数据将现有技术推向了极限,但幸运的是,两位同事(Ulrich Arndt和David Phillips)开发了一种自动衍射仪,并在任务的中途引入。数据被直接记录在穿孔纸带上,然后输入速度更快的计算机Edsac II。
在2Å的分辨率下,以前肌红蛋白多肽链中棒状的部分现在被显示为螺旋状,类似于鲍林已经在其他蛋白质中检测到的结构。利用这些数据,Kendrew和他的同事最终能够绘制出肌红蛋白复杂的3D结构,相当精确地定位了它的官能团(以及四分之三的单个原子)。(20世纪60年代,他们通过处理IBM 7090等大型计算机上25000次反射的数据,进一步将分辨率提高到1.4Å。)
肯德鲁对肌红蛋白结构的揭示——加上佩鲁茨在血红蛋白方面的成功,以及沃森、克里克、罗莎琳德·富兰克林和莫里斯·威尔金斯在核酸方面的平行进展——帮助发起了一场生物学革命。生命的组成部分和它们的组装指令终于变得触手可及。
以后的生活
多年来,肯德鲁一直积极参与这一迅速发展的领域。直到1987年,他都是《纽约时报》的主编分子生物学杂志(他于1959年创办了该杂志),后来他成为1997年《纽约时报》的主编分子生物学百科全书.他从1960年起成为英国皇家学会的会员,1965年获得皇家勋章,此后获得许多其他荣誉,包括1974年被授予爵士头衔。
肯德鲁的影响远远超出了学术界的界限。他1964年的BBC电视连续剧生命之线有助于使分子生物学的最新进展——以及它们对人类未来的重大影响——向公众开放。他还为历届英国政府提供专家建议,首先是作为科学政策委员会的成员,然后是国防科学咨询委员会的主席。与此同时,他鼓励国际科学合作,用流利的法语、德语和意大利语周游各地,为自己的专业进行游说。1975年,当欧洲分子生物学实验室(EMBL)在海德堡成立时,他成为了第一任总干事。
关于肯德鲁的个人生活,这里无需赘述。1948年,他娶了玛丽·贾维(Mary Jarvie)为妻,她后来成为了一名合格的医生。他们的婚姻于1956年破裂。从1947年到1975年,他是剑桥大学彼得学院的研究员,但1982年从EMBL退休后,他移居牛津大学,担任圣约翰学院院长直到1987年。肯德尔与联合国有着长期的联系,1997年他去世时,他的大部分遗产都捐给了一个支持发展中国家学生的基金。











暂无评论